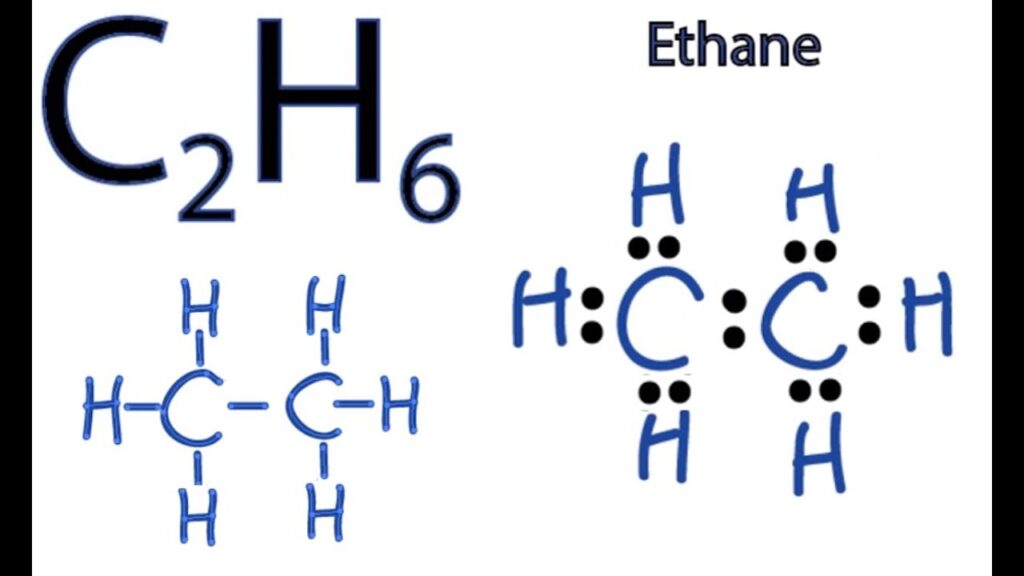
Phản ứng trên là phản ứng phân hủy hoàn toàn C2H6. Khi phản ứng xảy ra, 1 phân tử C2H6 bị phân hủy thành 2 phân tử C2H4 và H2. Phản ứng này là một quá trình rất quan trọng trong hóa học và được sử dụng rộng rãi trong sản xuất hóa chất và năng lượng.
Đầu tiên. Phương trình phản ứng C2h4 thư rác2h6
CŨ2h4 + BẠN BÈ2 → CŨ2h6
CH2=CH2 + H2 → CH3-CH3
2. Tính chất phản ứng C2H6 → C2H4 + H2:
Phản ứng trên là phản ứng phân hủy hoàn toàn C2H6. Khi phản ứng xảy ra, 1 phân tử C2H6 bị phân hủy thành 2 phân tử C2H4 và H2. Phản ứng này là một quá trình rất quan trọng trong hóa học và được sử dụng rộng rãi trong sản xuất hóa chất và năng lượng.
Trong phản ứng, C2H6 bị phân hủy thành hai phân tử C2H4 và một phân tử H2. Điều này có thể diễn ra ở nhiệt độ cao và trong môi trường xúc tác như Pt, Pd, Rh, Ni, Co, Fe, CrO3, V2O5 hoặc Al2O3. Việc sử dụng chất xúc tác có thể tăng tốc độ phản ứng và giảm nhiệt độ cần thiết cho phản ứng diễn ra.
Các điều kiện phản ứng bao gồm nhiệt độ cao và môi trường chất xúc tác. Khi phản ứng xảy ra ở nhiệt độ cao và có mặt chất xúc tác thì tốc độ phản ứng tăng lên đáng kể. Ngoài ra, một số chất xúc tác có thể ổn định sản phẩm phản ứng và giảm tỷ lệ sản phẩm phụ.
Ứng dụng của phản ứng phân hủy C2H6 → C2H4 + H2 rất đa dạng. Sản phẩm của phản ứng này là C2H4 và H2 được dùng để sản xuất các hợp chất hữu cơ như nhựa, cao su, thuốc nhuộm, chất tẩy rửa… Trong sản xuất hóa chất, phản ứng C2H6 → C2H4 + H2 được dùng để sản xuất các hợp chất hữu cơ như polyetylen, polypropylen và các đồng phân buten. Các hợp chất này được sử dụng rộng rãi trong ngành công nghiệp nhựa, cao su và các sản phẩm sơn bảo vệ.
3. Điều kiện xảy ra phản ứng C2H6 → C2H4 + H2:
Phản ứng C2H6 → C2H4 + H2 là phản ứng hóa học quan trọng trong công nghiệp hóa chất. Để đạt được hiệu suất cao của phản ứng này, cần phải đáp ứng các yếu tố quan trọng như nhiệt độ, áp suất và chất xúc tác.
– Nhiệt độ cao: phản ứng này xảy ra ở nhiệt độ cao, thường được thực hiện trong môi trường có nhiệt độ từ 500°C đến 800°C. Khi nhiệt độ tăng, động năng của phân tử tăng làm cho phản ứng diễn ra nhanh hơn và tạo ra sản phẩm mong muốn. Tuy nhiên, đẩy nhiệt độ lên quá cao có thể dẫn đến phân hủy sản phẩm, làm hỏng quá trình sản xuất.
– Áp suất cao: để đẩy phản ứng về phía sản phẩm cần tạo áp suất cao trong hệ thống phản ứng. Áp suất cao làm giảm khả năng xảy ra phản ứng phụ, tăng khả năng xảy ra phản ứng chính. Do đó, các nhà sản xuất thường sử dụng máy tạo áp suất cao để đảm bảo phản ứng hiệu quả. Tuy nhiên, việc tạo áp suất cao cũng đòi hỏi hệ thống kỹ thuật chính xác, đảm bảo an toàn cho người và thiết bị.
– Dùng xúc tác: phản ứng C2H6 → C2H4 + H2 cần dùng xúc tác như Ni, Pt, Pd để tăng tốc độ phản ứng. Chất xúc tác giúp tạo điều kiện lý tưởng cho phản ứng xảy ra, làm giảm năng lượng hoạt hóa và tăng tốc độ phản ứng. Xúc tác có thể được tái sử dụng nhiều lần, giúp giảm chi phí sản xuất.
Thỏa mãn các điều kiện trên sẽ giúp phản ứng diễn ra hiệu quả và thu được sản phẩm mong muốn. Tuy nhiên, để đạt được hiệu suất cao nhất, ngoài các yếu tố trên còn cần quan tâm đến nhiều yếu tố khác như độ tinh khiết của các chất phản ứng, thời gian phản ứng, độ ẩm và ánh sáng. Tối ưu hóa các yếu tố trên sẽ giúp tăng hiệu quả sản xuất, giảm chi phí và giảm tác động của sản xuất đến môi trường.
4. Ứng dụng của phản ứng C2H6 → C2H4 + H2:
Phản ứng C2H6 → C2H4 + H2 là phản ứng hóa học trong đó C2H6 (etan) phân hủy thành 2 sản phẩm là C2H4 (etilen) và H2 (hiđro). Đây là một phản ứng quan trọng trong lĩnh vực hóa học và có nhiều ứng dụng trong các lĩnh vực từ sản xuất nhựa đến sản xuất kim loại.
4.1. Sản xuất polyetylen và các sản phẩm nhựa khác:
Phản ứng C2H6 → C2H4 + H2 được dùng để sản xuất polyetylen, một loại nhựa dẻo và đàn hồi được sử dụng rộng rãi trong công nghiệp bao bì và đóng gói, sản xuất các sản phẩm y tế, sản phẩm điện tử. và nhiều ứng dụng khác. Polyetylen còn được dùng để sản xuất các sản phẩm nhựa khác như bao bì, túi nhựa, chai lọ, màng co, ống dẫn nước, dụng cụ y tế và nhiều sản phẩm khác.
4.2. Sản xuất chất bảo quản thực phẩm:
Các hợp chất sinh ra từ phản ứng C2H6 → C2H4 + H2 được dùng làm chất bảo quản thực phẩm để giữ cho thực phẩm tươi lâu hơn. Những chất bảo quản thực phẩm này được sử dụng rộng rãi trong ngành công nghiệp thực phẩm để giảm thiểu sự phát triển của vi khuẩn và nấm mốc, giữ cho thực phẩm tươi lâu hơn và bảo toàn chất lượng dinh dưỡng của sản phẩm.
4.3. Sản xuất chất oxy hóa:
Hydro được tạo ra từ phản ứng C2H6 → C2H4 + H2 được sử dụng để sản xuất các chất oxy hóa trong các ứng dụng công nghiệp như sản xuất thuốc nhuộm và chất tẩy rửa. Những chất oxy hóa này được sử dụng để tẩy trắng, tẩy trắng và làm sạch các sản phẩm khác nhau. Ngoài ra, hydro được sử dụng để sản xuất chất hoạt động bề mặt và các hợp chất hữu cơ khác.
4.4. Sản xuất kim loại từ quặng:
Phản ứng C2H6 → C2H4 + H2 dùng để sản xuất kim loại từ quặng trong quá trình khai thác kim loại. Hydro sinh ra từ phản ứng này được dùng để khử oxi hóa kim loại, làm tăng tính dẻo của kim loại và giảm mài mòn bề mặt kim loại.
Trên đây là một số ứng dụng của phản ứng C2H6 → C2H4 + H2 trong các lĩnh vực khác nhau. Phản ứng này có thể được sử dụng trong nhiều ứng dụng công nghiệp khác nhau và đóng vai trò quan trọng trong việc sản xuất nhiều sản phẩm.
5. Tính chất hóa học của Etylen:
Ethylene là một hợp chất hữu cơ bao gồm hai nguyên tử carbon được nối với nhau bằng liên kết đôi. Liên kết này bao gồm một liên kết yếu dễ bị phá vỡ khi tiến hành phản ứng hóa học. Tuy nhiên, đây cũng là một đặc điểm quan trọng giúp ethylene tham gia vào nhiều phản ứng hóa học khác nhau.
5.1. Etylen phản ứng với oxi:
Khi đốt cháy etilen trong không khí, nó cháy tạo thành CO2 và H2O, tỏa nhiều nhiệt. Phản ứng này được sử dụng trong nhiều ứng dụng khác nhau, chẳng hạn như trong sản xuất các sản phẩm hóa học hoặc trong các quy trình sản xuất năng lượng.
Ngoài ra, etilen còn làm mất màu dung dịch KMnO4, phản ứng thường dùng để xác định tính chất hóa học của một số hợp chất khác.
5.2. Etylen phản ứng với brom trong dung dịch:
Khi etilen tác dụng với dung dịch brom thì phản ứng tạo ra Br – CH2 – CH2 – Br. Phản ứng này là một trong những phản ứng quan trọng giúp xác định tính chất hóa học và ứng dụng công nghiệp của etylen.
5.3. Etylen tác dụng H2:
Khi ethylene phản ứng với hydro, phản ứng sẽ tạo ra CH3-CH3. Đây là một phản ứng quan trọng trong sản xuất các hợp chất hữu cơ khác, chẳng hạn như propan hoặc butan.
5.4. Phản ứng ngưng tụ:
Các phân tử Ethylene có thể kết hợp với nhau để tạo thành một chất mới có khối lượng phân tử lớn hơn, được gọi là PolyEthiten hay PE. Phản ứng này thường được sử dụng để sản xuất các vật liệu nhựa như tấm nhựa, túi nhựa, chai nhựa, ống nhựa, v.v.
Ethylene là một hợp chất quan trọng trong hóa học và có nhiều ứng dụng trong cuộc sống hàng ngày. Tuy nhiên, việc sử dụng ethylene cần đúng cách để đảm bảo an toàn cho sức khỏe và môi trường. Hiện nay, các nhà khoa học đang nghiên cứu để tìm ra các phương pháp sản xuất ethylene an toàn và bền vững hơn, góp phần bảo vệ môi trường và sức khỏe con người.
6. Bài tập liên quan:
Câu hỏi 1. Cho 4 chất sau: metan, etilen, but-1-in, but-2-in. Số chất có thể phản ứng với AgNO. giải pháp3 trong NH3 dư tạo thành kết tủa là
A. 4
B. 3
C. 2
D.1
Câu 2. Trong phân tử etilen giữa hai nguyên tử cacbon có
A. hai liên kết đôi.
B. một liên kết đôi.
C. một liên kết đơn.
D. một liên kết ba.
Câu 3. Khi đốt cháy khí etilen thu được số mol CO2 và họ2O được tạo thành theo tỉ lệ
A. 2 : 1.
B. 1:2.
C. 1:3.
D. 1:1.
Câu .4 Etylen và axetilen phản ứng được với tất cả các chất và dung dịch trong dãy nào sau đây?
A. HỌ2dung dịch NaOH, HCl.
B.CO2h2dung dịch KMnO4.
C. Br . giải pháp2Dung dịch HCl, AgNO. giải pháp3/BÉ NHỎ3 dư.
D. Br . giải pháp2dung dịch HCl, dung dịch KMnO4.