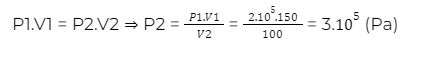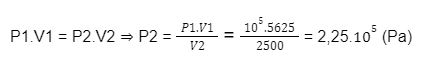Định luật Bôi-lơ Ma-ri-ốt đã góp phần quan trọng trong việc nắm bắt và áp dụng kiến thức vật lý để giải quyết các vấn đề thực tế, đồng thời tạo ra cơ sở cho sự phát triển và ứng dụng của nhiều ngành công nghiệp và công nghệ hiện đại. Dưới đây là bài viết về chủ đề: Quá trình đẳng nhiệt là gì? Nội dung định luật Bôi-lơ-Ma-ri-ốt?, mời bạn đọc theo dõi.
1. Quá trình đẳng nhiệt là gì?
Quá trình đẳng nhiệt là một khái niệm quan trọng trong lĩnh vực vật lý, liên quan đến sự biến đổi trạng thái của chất khí dưới điều kiện nhiệt độ không thay đổi. Anh gọi nó là “Isothermal Process,” một thuật ngữ chứa đựng sự ý nghĩa của việc duy trì nhiệt độ không đổi trong suốt quá trình biến đổi.
Để tìm hiểu sâu hơn về quá trình đẳng nhiệt, hãy xem xét một ví dụ cụ thể. Giả sử chúng ta có một ống xilanh chứa không khí ban đầu ở một áp suất và nhiệt độ thấp. Bằng cách sử dụng piston và áp dụng lực từ từ để nén không khí, chúng ta thay đổi thể tích của nó. Khi chúng ta thay đổi thể tích, áp suất của không khí trong ống cũng sẽ thay đổi theo.
Ví dụ trên chính là một quá trình đẳng nhiệt. Trong quá trình này, nhiệt độ của không khí được giữ nguyên, do đó nhiệt độ không thay đổi. Điều này có nghĩa là chúng ta đang xem xét sự biến đổi của áp suất và thể tích khi nhiệt độ không đổi.
Một cách để hiểu rõ hơn về quá trình đẳng nhiệt là thông qua biểu đồ pV (áp suất – thể tích). Khi thực hiện thí nghiệm để thay đổi thể tích của không khí và đồng thời đo áp suất tương ứng, chúng ta có thể thu được bảng dữ liệu như sau:
| Thể tích V (cm3) | Áp suất P (105 Pa) | pV |
| 20 | 1.00 | 2 |
| 10 | 2.00 | 2 |
| 40 | 0.5 | 2 |
| 30 | 0.67 | 2 |
Từ bảng dữ liệu này, ta có thể thấy rằng trong quá trình đẳng nhiệt, tích của áp suất và thể tích (pV) duy trì một giá trị không đổi (trong trường hợp này là 2). Điều này xác nhận rằng áp suất và thể tích của chất khí tỉ lệ thuận với nhau trong quá trình đẳng nhiệt.
Quá trình đẳng nhiệt có ý nghĩa quan trọng trong nhiều ứng dụng, từ ngành công nghiệp đến nghiên cứu về hệ thống năng lượng. Việc hiểu và nắm vững cơ chế của quá trình này giúp chúng ta dễ dàng dự đoán và mô hình hóa sự biến đổi của chất khí dưới điều kiện nhiệt độ không thay đổi, đồng thời cung cấp cơ sở cho việc phân tích và ứng dụng trong thực tế.
2. Nội dung định luật Bôi-lơ-Ma-ri-ốt:
Định luật Bôi-lơ Ma-ri-ốt là một trong những khái niệm quan trọng trong lĩnh vực vật lý và liên quan chặt chẽ đến sự biến đổi của khí dưới điều kiện đẳng nhiệt. Hãy cùng khám phá chi tiết về định luật này để hiểu rõ hơn về tầm quan trọng và lịch sử phát triển của nó.
Phát biểu định luật Bôi-lơ Ma-ri-ốt Định luật Bôi-lơ Ma-ri-ốt nêu rõ mối quan hệ giữa áp suất và thể tích của một lượng khí cụ thể trong quá trình đẳng nhiệt, tức là quá trình mà nhiệt độ của khí được duy trì ổn định.
– Theo định luật này, áp suất (p) và thể tích (V) của khí đối nghịch nhau theo một quy luật tỉ lệ. Điều này có nghĩa rằng khi áp suất tăng lên, thể tích của khí sẽ giảm, và ngược lại, khi áp suất giảm xuống, thể tích của khí sẽ tăng lên. Điều này chỉ xảy ra trong trường hợp khí đang trải qua một quá trình đẳng nhiệt, tức là nhiệt độ không thay đổi.
– Lịch sử và người khởi xướng: Định luật Bôi-lơ Ma-ri-ốt được đặt tên dựa trên hai nhà vật lý nổi tiếng, người Anh Robert Boyle (1627 – 1691) và người Pháp Edme Mariotte (1620 – 1684). Hai nhà khoa học này độc lập nhau khám phá và chứng minh định luật tương tự vào thời kỳ 1662 và 1676. Do đó, định luật này thường được gọi là Bôi-lơ Ma-ri-ốt để tôn vinh cả hai nhà vật lý đồng thời.
– Tầm quan trọng và ứng dụng: Định luật Bôi-lơ Ma-ri-ốt có tầm quan trọng rất lớn trong vật lý, đặc biệt là trong lĩnh vực nghiên cứu về hành vi của khí. Nó cung cấp cho chúng ta một cách để hiểu sự biến đổi của áp suất và thể tích trong
– Ứng dụng của định luật: Bôi-lơ Ma-ri-ốt có thể thấy trong nhiều lĩnh vực như công nghiệp, nghiên cứu về hệ thống năng lượng, thiết kế và vận hành máy nén khí, thiết bị làm lạnh và nhiều ứng dụng khác. Việc hiểu rõ định luật này giúp kỹ sư và nhà nghiên cứu có cơ sở để tối ưu hóa thiết kế và hoạt động của các thiết bị và quá trình liên quan đến khí.
Như vậy, định luật Bôi-lơ Ma-ri-ốt đã góp phần quan trọng trong việc nắm bắt và áp dụng kiến thức vật lý để giải quyết các vấn đề thực tế, đồng thời tạo ra cơ sở cho sự phát triển và ứng dụng của nhiều ngành công nghiệp và công nghệ hiện đại.
3. Công thức đẳng nhiệt:
Công thức đẳng nhiệt là một phần quan trọng của định luật Bôi-lơ Ma-ri-ốt, nó giúp mô tả mối quan hệ giữa áp suất và thể tích của một lượng khí trong quá trình đẳng nhiệt. Hãy cùng đi sâu hơn vào công thức này để hiểu rõ hơn về cách nó hoạt động và tầm quan trọng của nó trong vật lý.
Công thức đẳng nhiệt: Công thức đẳng nhiệt được biểu diễn bằng phương trình:
pV = const (hằng số) hay p ~ 1V
Trong đó:
- p là áp suất của khí (Pascal, Pa)
- V là thể tích của khí (cubic centimeters, cm³)
Công thức trên cho thấy tích của áp suất và thể tích của một lượng khí trong quá trình đẳng nhiệt luôn giữ nguyên giá trị hằng số.
Ví dụ cụ thể: Giả sử bạn có một ống xilanh chứa một lượng khí và bạn thay đổi thể tích của nó trong một quá trình đẳng nhiệt. Khi bạn nén khí bằng cách thay đổi thể tích, áp suất của khí sẽ thay đổi theo một tỷ lệ nghịch với thể tích, sao cho tích pV luôn duy trì giá trị không đổi. Điều này có nghĩa rằng, khi bạn nhân áp suất và thể tích của khí tại một trạng thái nào đó, bạn sẽ luôn nhận được giá trị hằng số.
Tầm quan trọng của công thức đẳng nhiệt: Công thức đẳng nhiệt pV = const chứng minh mối quan hệ tương quan giữa áp suất và thể tích của khí trong quá trình đẳng nhiệt. Đây không chỉ là một phương trình toán học, mà còn là một cơ sở quan trọng trong vật lý khí và nhiệt động học.
Công thức này giúp các nhà khoa học, kỹ sư và người nghiên cứu có thể dự đoán và hiểu sự biến đổi của khí dưới điều kiện đẳng nhiệt. Nó cũng có thể được áp dụng trong thiết kế và vận hành các thiết bị liên quan đến khí như máy nén khí, động cơ nhiệt, hệ thống làm lạnh và nhiều ứng dụng khác.
Tóm lại, công thức đẳng nhiệt pV = const là một công cụ mạnh mẽ để hiểu và mô hình hóa sự biến đổi của khí trong quá trình đẳng nhiệt, đồng thời giúp tạo ra cơ sở cho việc áp dụng kiến thức vật lý vào thực tế trong nhiều lĩnh vực khác nhau.
4. Đường đẳng nhiệt:
Đường đẳng nhiệt: Đường đẳng nhiệt là một đường cong được vẽ trên biểu đồ áp suất – thể tích (pV) để biểu diễn mối quan hệ giữa áp suất và thể tích của một lượng khí trong quá trình đẳng nhiệt. Trong đường đẳng nhiệt, nhiệt độ của khí được duy trì ổn định trong suốt quá trình, do đó sự biến thiên của áp suất phụ thuộc vào thể tích của khí.
Đường đẳng nhiệt trên biểu đồ pV thường có hình dạng là một đường cong huyền bí. Điều thú vị là đường đẳng nhiệt có dạng hyperbol và chia làm hai phần đối xứng qua trục thể tích. Điều này có nghĩa rằng, nếu bạn chia đường đẳng nhiệt ra làm hai phần qua trục thể tích, thì sự biến đổi của áp suất ở phần trên đối xứng với sự biến đổi của áp suất ở phần dưới.
Tính chất của đường đẳng nhiệt:
– Sự biến đổi của áp suất và thể tích: Đường đẳng nhiệt cho thấy áp suất và thể tích của khí biến đổi theo một quy luật cụ thể. Khi thể tích giảm đi, áp suất tăng lên và ngược lại, áp suất giảm khi thể tích tăng lên.
– Hình dạng đường cong: Đường đẳng nhiệt có hình dạng hyperbol với hai phần đối xứng qua trục thể tích. Sự biến thiên của áp suất và thể tích theo đường đẳng nhiệt tuân theo phương trình pV = const.
– Ứng dụng: Đường đẳng nhiệt đóng vai trò quan trọng trong việc hiểu và mô hình hóa sự biến đổi của khí trong quá trình đẳng nhiệt. Nó cũng giúp định rõ mối liên hệ giữa áp suất và thể tích của khí ở nhiều trạng thái khác nhau.
Tóm lại, đường đẳng nhiệt là một biểu đồ thể hiện mối quan hệ giữa áp suất và thể tích của một lượng khí trong quá trình đẳng nhiệt. Hình dạng hyperbol của đường đẳng nhiệt và tính chất biến thiên của áp suất và thể tích giúp ta hiểu rõ hơn về sự ảnh hưởng của nhiệt độ đối với các đại lượng này trong môi trường đẳng nhiệt.
5. Bài tập liên quan đến quá trình đẳng nhiệt:
Bài 1: Một xilanh chứa 150 cm3 khí ở áp suất 2.10^5 Pa.Pit-tông nén khí trong xilanh xuống còn 100 cm3.Tính áp suất của khí trong xilanh lúc này, coi nhiệt độ như không đổi.
Hướng dẫn giải:
Áp dụng công thức định luật Bôi – lơ Ma – ri – ốt:
Bài 2: Một quả bóng có dung tích 2,5 lít. Người ta bơm không khí ở áp suất 10^5 Pa vào bóng. Mỗi lần bơm được 125 cm3 không khí. Tính áp suất của không khí trong quả bóng sau 45 lần bơm. Coi quả bóng trước khi bơm không có không khí và trong khi bơm nhiệt độ của không khí không thay đổi.
Hướng dẫn giải:
45 lần bơm đã đưa vào quả bóng một lượng khí ở bên ngoài có thể tích và áp suất tương ứng là:
V1 = 45. 125 = 5625 (cm3)
P1 = 10^5 Pa
Khi nhốt hết lượng khí trên vào quả bóng thì nó có thể tích là bằng thể tích quả bóng: V2= 2,5 lít = 2500 cm3 và một áp suất là P2
Quá trình là đẳng nhiệt, áp dụng công thức định luật Bôi-lơ-Ma-ri-ốt: