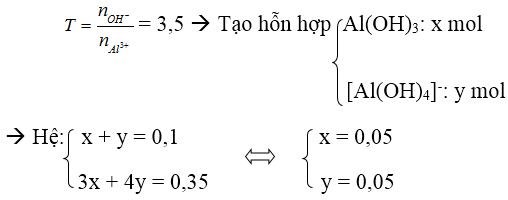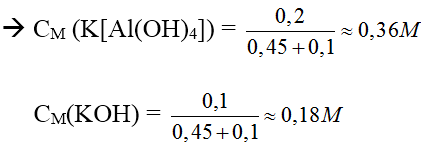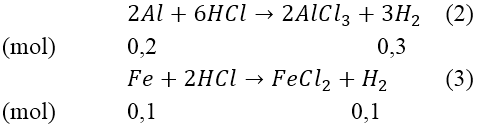Nhôm hidroxit là gì? Tính chất vật lý, tính chất hóa học của nhôm hidroxit là gì? Ứng dụng của nó trong đời sống ra sao? Nhôm hidroxit được điều chế như thế nào? Bài viết dưới đây sẽ giải đáp thắc mắc đó.
1. Nhôm hidroxit là gì?
Nhôm hydroxit hay với tên gọi hóa học là Al(OH)3 là một hợp chất hóa học có nguồn gốc từ 1 loại khoáng. Loại khoáng này ban đầu được tìm thấy có cái tên đó là Gibbsite (hay Hydragilit). Ngoài có nguồn gốc từ dạng khoáng, Al(OH)3 còn mang các tính chất của ba chất đa hình hiếm gặp hơn đó là: bayerit, doyleite và nordstrandite.
Gibbsite là một loại cấu trúc kim loại Hydroxit điển hình có các dạng liên kết Hydro. Gibbsite được tạo nên từ nhiều lớp kép của các nhóm Hydroxyl với đa phần các ion nhôm chiếm tới 2/3 trong số các lỗ bát diện giữa hai lớp.
Chính vì sự ra đời với nhiều nguồn gốc xuất thân như thế nên Nhôm Hydroxit là một loại hợp chất hóa học lưỡng tính. Cụ thể hơn về loại hợp chất lưỡng tính, Nhôm hydroxit lưỡng tính có trong tự nhiên luôn có cả 2 tính chất đó là tính bazo và tính axit. Có liên quan chặt chẽ nhất đến dạng chất đó là nhôm oxit – Al2O3.
Nói thêm về nhôm Oxit thì đây cũng là một dạng chất lưỡng tính. Có trong tự nhiên và là hợp chất cộng lại của các thành phần chính của bauxite quặng nhôm.
2. Tính chất hoá vật lý của nhôm hidroxit:
2.1. Tính chất vật lý của nhôm hidroxit:
– Nhôm hidroxit thường tồn tại dưới dạng các tinh thể kết tinh không màu hoặc có màu trắng. Nó có dạng bột mịn khi được nghiền nhỏ.
– Tính chất tinh thể: Nhôm hidroxit có cấu trúc tinh thể dạng hệ một trục (trigonal) với các phân tử Al(OH)3 sắp xếp hình cầu đối xứng xung quanh nguyên tử nhôm.
– Điểm nóng chảy và sôi: Nhôm hidroxit không có điểm nóng chảy rõ rệt, thay vào đó, nó phân hủy thành nhôm oxit (Al2O3) và nước khi được đun nóng. Điều này thường xảy ra ở nhiệt độ cao hơn 200 độ Celsius.
– Tính tan và hòa tan: Nhôm hidroxit không tan trong nước, nhưng nó có thể tan trong axit mạnh và kiềm mạnh, tạo thành các muối hòa tan.
– Tính chất hóa học: Nhôm hidroxit có tính chất amphoteric, nghĩa là nó có thể tác dụng như một axit hoặc một bazơ trong các phản ứng hóa học. Nó có khả năng tương tác với cả axit mạnh và kiềm mạnh.
– Tính chất hút ẩm: Nhôm hidroxit có khả năng hút ẩm từ
– Khối lượng phân tử: Khối lượng phân tử của nhôm hidroxit là khoảng 78,0035 g/mol.
– Độ dẻo và cứng: Nhôm hidroxit là một chất rắn dễ nghiền, và nó có tính chất dẻo khi được ép hoặc nén.
Những tính chất vật lý này ảnh hưởng đến cách nhôm hidroxit được sử dụng trong các ứng dụng khác nhau, bao gồm sản xuất nhôm, công nghiệp hóa chất, dệt may, và nhiều ngành công nghiệp khác.
2.2. Tính chất hóa học của nhôm hidroxit:
– Tính amphoteric: Nhôm hidroxit có tính chất amphoteric, nghĩa là nó có khả năng tương tác với cả acid và base. Khi tiếp xúc với acid mạnh, nhôm hidroxit có thể tạo ra muối nhôm, ví dụ như AlCl3, bằng cách thay thế các ion hydroxide (OH-) bằng ion hydrogen (H+). Khi tiếp xúc với base mạnh, nó có thể tạo ra các phức chất alkali như Al(OH)4- bằng cách thay thế các ion hydrogen bằng ion hydroxide.
– Tính chất tan: Nhôm hidroxit ít tan trong nước ở nhiệt độ thường do tính chất kém tan của các ion hydroxide (OH-) trong nước. Tuy nhiên, nó có thể tan trong acid mạnh và base mạnh để tạo ra các muối nhôm hoặc phức chất alkali.
– Phản ứng nhiệt phân: Nhôm hidroxit phân hủy khi nung nóng ở nhiệt độ cao hơn 200 độ Celsius, tạo ra nhôm oxit (Al2O3) và nước (H2O) theo phản ứng sau:
2Al(OH)3 → Al2O3 + 3H2O
– Khả năng hút ẩm: Nhôm hidroxit có khả năng hút ẩm từ không khí xung quanh, và điều này có thể làm cho nó trở thành một chất hấp thụ nước hiệu quả.
– Tính chất tạo gel: Nhôm hidroxit cũng có khả năng tạo ra gel trong nước khi nó kết hợp với nước. Điều này có ứng dụng trong sản xuất các sản phẩm chất lỏng như mỹ phẩm và dược phẩm.
– Tính chất chống cháy: Nhôm hidroxit cũng được sử dụng trong sản xuất các vật liệu chống cháy, bởi vì nó có khả năng tạo ra một lớp bảo vệ oxide (Al2O3) ở bề mặt vật liệu khi nó tiếp xúc với nhiệt độ cao, giúp ngăn cháy lan.
Những tính chất hóa học này của nhôm hidroxit làm cho nó có nhiều ứng dụng trong ngành công nghiệp hóa chất, sản xuất nhôm, và nhiều lĩnh vực khác nhau.
3. Cách điều chế nhôm hidroxit:
Nhôm hidroxit thường được điều chế từ quặng bauxite, nguồn nguyên liệu chính để sản xuất nhôm. Dưới đây là quy trình chung để điều chế nhôm hidroxit:
– Nghiền quặng bauxite: Quặng bauxite được nghiền thành hạt nhỏ để tạo ra bột bauxite. Quá trình nghiền này nhằm giảm kích thước của quặng và tạo điều kiện tốt hơn cho các phản ứng hóa học sau này.
– Phản ứng Bayer: Bột bauxite được hòa tan trong dung dịch nước kiềm mạnh (thường là dung dịch natric hydroxit, NaOH) trong một thiết bị gọi là bể phản ứng Bayer. Phản ứng này tạo ra một dung dịch chứa các ion nhôm, cùng với các tạp chất không phải là nhôm như sắt và silic.
Phản ứng: Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
– Tách chất cặn: Sau phản ứng Bayer, dung dịch được chuyển đến các bể kết tinh để tách chất cặn (bao gồm các tạp chất không phải là nhôm) khỏi dung dịch.
– Sinh ra CO2: Dung dịch sau đó được đưa qua các bể nung nóng, nơi mà dùng CO2 được thông qua. Phản ứng này tạo ra các hạt nhỏ của nhôm hidroxit.
Phản ứng: Na[Al(OH)4] + CO2 → Al(OH)3 + NaHCO3
– Lọc và tẩy lọc: Nhôm hidroxit sau đó được tách ra khỏi dung dịch, thường bằng cách sử dụng các bộ lọc hoặc các
– Nung nóng: Cuối cùng, nhôm hidroxit được đưa vào lò nung nóng để loại bỏ nước còn lại và tạo ra nhôm oxit cuối cùng (Al2O3).
Phản ứng: 2Al(OH)3 → Al2O3 + 3H2O
Sau quá trình này, nhôm hidroxit sẽ được sử dụng trong nhiều ứng dụng khác nhau, bao gồm trong sản xuất nhôm, công nghiệp hóa chất, và các ngành công nghiệp khác.
4. Ứng dụng của nhôm hidroxit:
Nhôm hidroxit (Aluminum Hydroxide) có nhiều ứng dụng quan trọng trong nhiều lĩnh vực khác nhau:
– Dược phẩm:
Thuốc kháng axit dạ dày: Nhôm hidroxit được sử dụng trong các loại thuốc dùng để giảm triệu chứng đầy bụng, trào ngược dạ dày, và đau dạ dày. Nó hoạt động bằng cách làm giảm acid dạ dày.
– Chất xử lý nước:
Nhôm hidroxit được sử dụng để điều chỉnh độ pH trong nước, đặc biệt trong quá trình xử lý nước cung cấp cho các
– Công nghiệp dệt may và giấy:
Nhôm hidroxit được sử dụng làm chất tẩy trắng trong công nghiệp dệt may và giấy để làm cho sợi vải và giấy trắng hơn.
– Công nghiệp hóa chất:
Chất chống cháy: Nhôm hidroxit được sử dụng làm chất chống cháy trong sản xuất vật liệu cần độ bền chống cháy cao, như các vật liệu xây dựng hoặc vật liệu điện tử.
– Sản xuất nhôm:
Nhôm hidroxit là nguyên liệu chính để sản xuất nhôm. Quá trình nhiệt phân nhôm hidroxit tạo ra nhôm oxit, một bước quan trọng trong quá trình sản xuất nhôm.
– Mỹ phẩm và chăm sóc cá nhân:
Do khả năng tạo gel của nó trong nước, nhôm hidroxit thường được sử dụng trong các sản phẩm mỹ phẩm như kem dưỡng da và mỹ phẩm trang điểm.
– Chất
Nhôm hidroxit cũng được sử dụng như một chất phụ gia thực phẩm để điều chỉnh độ pH hoặc làm chất chống đông.
– Công nghiệp sản xuất giấy và sợi tổng hợp:
Nhôm hidroxit có thể được sử dụng để điều chỉnh độ pH trong quá trình sản xuất giấy và sợi tổng hợp.
– Sản xuất thuốc nhuộm và chất tẩy trắng:
Nhôm hidroxit có thể được sử dụng như một chất nền trong các loại thuốc nhuộm và chất tẩy trắng.
– Chất xử lý nước thải:
Nó được sử dụng trong các ứng dụng xử lý nước thải để kết tủa các chất hữu cơ và các kim loại nặng.
Nhôm hidroxit đóng vai trò quan trọng trong nhiều lĩnh vực công nghiệp và tiếp tục được sử dụng rộng rãi trong các ứng dụng khác nhau.
5. Bài tập vận dụng:
Bài 1: Rót 100 ml dung dịch NaOH 3,5M vào 100 ml dung dịch AlCl3 1M thu được m gam kết tủa. Tính m?
Lời giải:
Ta có: nNaOH = 0,35 mol, nAlCl3 = 0,1 mol
Vận dụng tỉ lệ T
nOH– = 0,35 mol, nAl3+ = 0,1 mol
→ m↓ = 0,05 . 78 = 3,9 g
hoặc T = 3,5 nên
Bài 2: Cho 450 ml dung dịch KOH 2M tác dụng với 100 ml dung dịch Al2(SO4)3 1M được dung dịch X. Tính
Lời giải:
nOH– = 0,9 mol, nAl3+ = 0,2 mol
→ Tạo [Al(OH)4]– và OH– dư
Dung dịch X có
Bài 3: Cho m gam hỗn hợp bột Al và Fe tác dụng với dung dịch NaOH dư thấy thoát ra 6,72 lít khí (đktc). Nếu cho m gam hỗn hợp trên tác dụng với dung dịch HCl dư thì thấy thoát ra 8,96 lít khí (đktc). Tính khối lượng của Al và Fe trong hỗn hợp ban đầu.
Lời giải:
Ta có: nH2(1) = 6,72/22,4 = 0,3(mol)
Từ (1) ⇒ nAl = 0,2(mol) ⇒ mAl = 0,2*27 = 5,4 (gam)
Mà nH2(2)(3) = 8,96/22,4 = 0,4(mol)
Từ (2) và (3) suy ra: mFe = 0,1*56 = 5,6(gam)