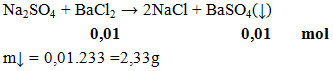BaCl2 + Na2SO4 → BaSO4 + NaCl là tài liệu vô cùng hữu ích giúp bạn đọc tiết kiệm thời gian và công sức. Dưới đây là các chi tiết để bạn tham khảo.
1. Phương trình phản ứng BaCl2 + Na2SO4 → BaSO4 + NaCl:
Na2VÌ THẾ4 + BaCl2 → 2NaCl + BaSO4( )
2. Điều kiện để xảy ra phản ứng BaCl2 + Na2SO4 → BaSO4 + NaCl:
Đáp ứng ở điều kiện bình thường.
Điều kiện phản ứng trong phương trình hóa học BaCl2 + Na2SO4 → BaSO4 + 2NaCl là:
– Phản ứng xảy ra trong dung dịch: Các chất tham gia BaCl2 và Na2SO4 thường được hòa tan trong nước tạo thành dung dịch trước khi phản ứng xảy ra.
– Trong dung dịch cần có sự có mặt của các chất: BaCl2 và Na2SO4 thì mới phản ứng được với nhau.
– Điều kiện pH: Phản ứng xảy ra trong dung dịch nên điều kiện pH của dung dịch có thể ảnh hưởng đến tốc độ và hiệu suất của phản ứng.
– Nhiệt độ: Thông thường tăng nhiệt độ có thể làm tăng tốc độ phản ứng, nhưng cần lưu ý đối với một số phản ứng, nhiệt độ quá cao có thể làm giảm hiệu suất phản ứng.
– Cân bằng ion: Các ion trong dung dịch như Cl-, SO42-, Na+ và Ba2+ phải cân bằng với nhau để tạo thành hợp chất mới.
– Tương tác phân tử: Phân tử của các chất tham gia phản ứng cần có tương tác hóa học phù hợp để xảy ra phản ứng.
3. Phản ứng giữa BaCl2 + Na2SO4 → BaSO4 + NaCl:
Có kết tủa trắng.
Phản ứng giữa BaCl2 (bari clorua) và Na2SO4 (natri sunfat) tạo ra BaSO4 (bari sunfat) và NaCl (natri clorua) theo phương trình hóa học sau:
– BaCl2 + Na2SO4 → BaSO4 + 2NaCl
– Trong phản ứng này, ion bari từ BaCl2 kết hợp với ion sunfat từ Na2SO4 để tạo thành kết tủa bari sunfat (BaSO4), trong khi hai ion natri từ Na2SO4 tạo thành muối natri clorua (NaCl).
– Đây là phản ứng trao đổi ion, trong đó ion của các chất tham gia đổi chỗ cho nhau tạo ra sản phẩm mới. BaSO4 kết tủa trắng và không tan trong nước, trong khi NaCl tan trong nước và muối trắng.
Phản ứng này cũng có thể được sử dụng để phân biệt giữa các ion bari và sulfat trong hóa học phân tích.
4. Phương trình rút gọn của BaCl2 + Na2SO4 → BaSO4 + NaCl:
Phương trình rút gọn của phản ứng BaCl2 + Na2SO4 → BaSO4 + 2NaCl là:
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
5. Bài tập liên quan:
Cách cân bằng phương trình BaCl2 + Na2SO4 → BaSO4 + NaCl:
Có thể cân bằng phương trình hóa học BaCl2 + Na2SO4 → BaSO4 + 2NaCl bằng cách điều chỉnh số phân tử của các chất trong phương trình. Đây là quá trình cân bằng phương trình:
– Đầu tiên, kiểm tra số lượng các số nguyên tố ở cả hai vế của phương trình. Vế trái có 1 nguyên tố Ba, 2 nguyên tố Cl, 1 nguyên tố Na và 1 nguyên tố S. Vế phải có 1 nguyên tố Ba, 1 nguyên tố S và 2 nguyên tố Cl. Do đó, cần phải điều chỉnh số lượng phân tử để các phần tử ở cả hai bên của phương trình trở nên bằng nhau.
– Bắt đầu từ yếu tố Ba, ta thấy 2 bên đều có 1 yếu tố Ba. Vì vậy, chúng ta không cần điều chỉnh số lượng phân tử Ba.
– Tiếp theo, nguyên tố Cl. Bên trái có 2 nguyên tố Cl trong BaCl2, trong khi bên phải chỉ có 2 nguyên tố Cl trong 2NaCl. Vì vậy, chúng ta không cần điều chỉnh số lượng phân tử Cl.
– Thì nguyên tố Na. Bên trái có 2 nguyên tố Na trong Na2SO4, trong khi bên phải có 2 nguyên tố Na trong 2NaCl. Do đó, chúng ta không cần điều chỉnh số lượng phân tử Na.
– Cuối cùng là nguyên tố S. Vế trái có 1 nguyên tố S trong Na2SO4, còn vế phải có 1 nguyên tố S trong BaSO4. Để cân bằng ta cần thêm vào trái một phân tử BaSO4 thì mới đủ nguyên tố S.
Vậy phương trình đã cân bằng như sau: BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Mẹo cân bằng phương trình hóa học BaCl2 + Na2SO4 → BaSO4 + NaCl chuẩn nhất:
Để cân bằng phương trình hóa học BaCl2 + Na2SO4 → BaSO4 + NaCl, bạn có thể làm theo các bước sau:
- Xác định số nguyên tố, số hiệu nguyên tử của mỗi nguyên tố trong phương trình.
BaCl2 + Na2SO4 → BaSO4 + NaCl Ba: 1; Na: 2; Cl: 2; S: 1; Ô: 4
- Bắt đầu cân bằng các yếu tố không liên quan đến oxy và hydro. Trong trường hợp này, chúng tôi bắt đầu với Ba và Na.
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
- Cân bằng oxi bằng cách thêm hệ số thích hợp vào hợp chất chứa oxi.
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
- Cuối cùng, cân bằng hydro bằng cách thêm các hệ số thích hợp vào các hợp chất chứa hydro.
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Sau các bước trên, phương trình được cân bằng: BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Cách giải phương trình BaCl2 + Na2SO4 → BaSO4 + NaCl:
Đây là phản ứng trao đổi ion, trong đó các ion ở chất khử và chất oxi hóa đổi chỗ cho nhau để tạo ra chất mới.
Phản ứng được viết dưới dạng phương trình cân bằng như sau:
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Để giải phương trình này, chúng ta cần xác định tỷ lệ mol thích hợp cho mỗi chất phản ứng. Trong trường hợp này, hệ số mol đã được cung cấp trước đó và không cần điều chỉnh. Phương trình trên đã được cân bằng với các hệ số phân tử như vậy.
Tóm lại, để giải phương trình BaCl2 + Na2SO4 → BaSO4 + NaCl, ta chỉ cần viết phương trình cân bằng và xác định hệ số mol tương ứng từng chất trong phản ứng.
Ví dụ 1:
thêm từ từ vài giọt Na2VÌ THẾ4 vào ống nghiệm chứa 1 ml BaCl .2 thu được kết tủa có màu
A. trắng. B. đen. C. vàng. D. màu nâu đỏ.
hướng dẫn giải
Na2VÌ THẾ4 + BaCl2 → 2NaCl + BaSO4( )
BaSO4( ) trắng
Đáp án A
Ví dụ 2:
Chất nào sau đây không phản ứng được với Na.?2VÌ THẾ4?
A. (CHỈ3giám đốc điều hành)2Bố. B. BaCl2. C. Ba(KHÔNG3)2. D, BaCO3.
hướng dẫn giải
BaCO3 không phản ứng với Na2VÌ THẾ4.
Đáp án D .
Ví dụ 3:
Khối lượng kết tủa thu được khi thêm Na2VÌ THẾ4 phản ứng vừa đủ với 100ml BaCl2 0,1 triệu là
A. 2,33 gam. B. 1,88 gam. C.1.44 gam. D. 2,00g
hướng dẫn giải
Đáp án A
Câu hỏi 1. Để nhận ra sự hiện diện của SO42- Chất nào sau đây được dùng trong dung dịch?
A. quỳ tím.
B. Mg . dung dịch muối2+ .
C. dung dịch chứa Ba. ion2+
D. thuốc thử duy nhất là Ba(OH)2
ĐÁP ÁN C
Để phát hiện sự hiện diện của SO . ion42- Trong dung dịch, dung dịch chứa Ba . ion được sử dụng2+.
Câu 2. Có 3 bình riêng biệt đựng 3 dung dịch HCl, Ba(NO3)2 và họ2VÌ THẾ4. Thuốc thử duy nhất có thể dùng để phân biệt các dung dịch này là?
A.NaCl . giải pháp
B. Dung dịch AgNO3
C. NaOH . giải pháp
D. quỳ tím
TRẢ LỜI DỄ DÀNG
Dùng quỳ tím nhận biết được 2 nhóm chất:
Nhóm axit HCl, H2VÌ THẾ4 làm quỳ tím chuyển sang màu đỏ
Không làm đổi màu quỳ tím như muối Ba(NO .)3)2
Dùng dung dịch Ba(NO .)3)2xác định nhóm axit
Nếu mẫu thử xuất hiện kết tủa trắng thì dung dịch axit ban đầu là H .2VÌ THẾ4
Ba (KHÔNG3)2+ BẠN BÈ2VÌ THẾ4 → BaSO4 + 2HNO3
Không có thứ gọi là HCl
Câu 3. Đối với Nà. giải pháp2VÌ THẾ4 vào dung dịch BaCl2 nhìn thấy
A. dung dịch chuyển sang màu đỏ.
B. có kết tủa trắng.
C. không có hiện tượng gì.
D. có bọt khí bay ra
Câu trả lời là không
phương trình phản ứng
BaCl2 + Nà2VÌ THẾ4 → BaSO4+ 2NaCl
Câu 4. Cho các phản ứng sau
(1) BaCl2 + BẠN BÈ2VÌ THẾ4;
(2) Ba(OH)2 + Nà2VÌ THẾ4;
(3) BaCl2 + ( NHỎ4)2VÌ THẾ4
(4) Ba(OH)2 + ( NHỎ4)2VÌ THẾ4;
(5) Ba(OH)2 + BẠN BÈ2VÌ THẾ4;
(6) Ba (KHÔNG3)2 + BẠN BÈ2VÌ THẾ4
Số phản ứng có phương trình ion thu gọn: Ba2+ + VẬY42-→ BaSO4 Được:
A. 4
B. 3
C. 5
mất 6
Xem câu trả lời
Đáp án A
(1) BaCl2 + BẠN BÈ2VÌ THẾ4 → BaSO4 + 2HCl
Phương trình ion thu gọn:
Bố2+ + VẬY42- → BaSO4
(2) Ba(OH)2 + Nà2VÌ THẾ4 → BaSO4 + 2NaOH
Phương trình ion thu gọn:
Bố2+ + VẬY42-→ BaSO4
(3) BaCl2 + ( NHỎ4)2VÌ THẾ4→ 2 NHỎ4Cl + BaSO4
phương trình ion thu gọn:
Bố2+ + VẬY42- → BaSO4
(4) Ba(OH)2+ ( NHỎ4)2VÌ THẾ4 → BaSO4+ 2NHS3 + 2 CĂN NHÀ2Ô
(5) Ba(OH)2 + BẠN BÈ2VÌ THẾ4 → BaSO4 + 2 CĂN NHÀ2Ô
(6) Ba (KHÔNG3)2 + BẠN BÈ2VÌ THẾ4 → BaSO4 + 2HNO3
Câu 5. Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch?
A. Zn + HUST2VÌ THẾ4 → ZnSO4 + BẠN BÈ2
B. BaCl2 + Nà2VÌ THẾ4 → BaSO4+ 2NaCl
C. 2Fe(NO .)3)3 + 2KI → 2Fe(KHÔNG3)2 + Tôi2 + 2KNO3
D. Zn + 2Fe(NO3)3 → Zn(KHÔNG3)2 + 2Fe(KHÔNG3)2
Câu trả lời là không
Câu 6. Khi cho dung dịch NaOH vào dung dịch muối nitrat nào thì không thấy kết tủa?
A. Cu(KHÔNG3)2.
B. Fe(KHÔNG3)3.
C.AgNO3.
D. Pb(KHÔNG3)2.
TRẢ LỜI DỄ DÀNG
Chọn D vì Pb(OH)2 Là hiđroxit lưỡng tính nên tan trong kiềm dư.
Pb(KHÔNG3)2 + 2NaOH → Pb(OH)2+ 2NaNO3
Pb(OH)2+ 2NaOH → Na2PbO2+ 2 CĂN NHÀ2Ô
Câu 7. Cho 26,8 gam hỗn hợp X gồm CaCO3 và MgCO3 dung dịch HCl vừa đủ thì có 3,36 lít khí thoát ra và dung dịch Y chứa m gam muối clorua. Giá trị của m là
A. 30,1.
B. 31,7.
C. 69,4.
D. 28,45.
TRẢ LỜI DỄ DÀNG
2 gia đình+ + CO32- → CO2 + BẠN BÈ2Ô
NCl– = nh+ = 2nCO2 = 0,3 mol
m = mX – mCO32- + mCl– = 26,8 – 0,15.60 + 0,3.35,5 = 28,45 gam
Câu 8. Có bao nhiêu kết tủa với BaCl2 trong: KOH; Na2VÌ THẾ4; VÌ THẾ3; NaHSO4; KỲ2VÌ THẾ4; Ca nô3)2
A. 3
B. 6
C. 5
mất 4
TRẢ LỜI DỄ DÀNG
Các chất đó là: SO3; NaHSO4; Na2VÌ THẾ4; KỲ2VÌ THẾ4
BaCl2 + VẬY3 → BaSO3 + Cl2
BaCl2+ NaHSO4 → BaSO4 + NaCl + HCl
BaCl2 + Nà2VÌ THẾ4→ BaSO4 + 2NaCl
BaCl2 + KỲ2VÌ THẾ4 → BaSO4+ 2KCl