Bảng nguyên tử khối là một trong những kiến thức Hoá học quan trọng trong chương trình trung học cơ sở, đặc biệt là đối với các bạn học sinh lớp 8. Vậy bảng nguyên tử khối là gì và làm sao để thuộc nhanh bảng nguyên tử khối?
Cùng INVERT tham khảo ngay bài viết sau để nắm được một số kiến thức về bảng nguyên khối bạn nhé!
Mục lục bài viết [Ẩn]

Định nghĩa nguyên tử khối của các nguyên tố hóa học
1. Nguyên tử khối là gì?
Nguyên tử khối (ma) là khối lượng của một nguyên tử, có đơn vị là khối lượng nguyên tử (u) hoặc khối lượng một nguyên tử carbon-12 (đvC). Theo đó, 1 đơn vị carbon thì bằng 1⁄12 khối lượng một nguyên tử carbon-12, ở trạng thái nghỉ.
Nguyên tử khối của một nguyên tử là khối lượng tương đối của nguyên tử nguyên tố và bằng tổng khối lượng notron, proton và electron. Tuy nhiên, Proton và nơ tron đều có khối lượng xấp xỉ 1u còn electron có khối lượng nhỏ hơn rất nhiều, khoảng 0,00055u. Vậy nên, có thể coi nguyên tử khối xấp xỉ số khối của hạt nhân.
Nguyên tử khối có phải số khối không? Số khối (kí hiệu A) là tổng số hạt trong hạt nhân nguyên tử. Được tính theo công thức A = Z + N với Z là số proton, N là số neutron.
Mà nguyên tử khối là khối lượng tương đối của một nguyên tử, còn số khối thì là số hạt trong hạt nhân nguyên tử. Do đó, đây là 2 khái niệm hoàn toàn khác nhau.
 2. Đơn vị của nguyên tử khối
2. Đơn vị của nguyên tử khối
Đơn vị khối lượng nguyên tử (Dalton) là một đơn vị đo khối lượng trong hóa học và vật lý. Dùng để đo khối lượng của các nguyên tử và phân tử và được quy ước bằng 1/12 khối lượng nguyên tử carbon đồng vị 12.
Trên thực tế, nguyên tử có khối lượng vô cùng bé, nếu tính bằng gram thì số trị vô cùng nhỏ.
Ví dụ: Khối lượng nguyên tử Cacbon (C) là 1,9926.10-23 g. Tại Việt Nam, người ta quy ước lấy 1/12 khối lượng của nguyên tử Cacbon làm đơn vị khối lượng cho nguyên tử được gọi là đơn vị cacbon viết tắt là đvC.
Lưu ý:
- Hidro là nguyên tử nhẹ nhất.
- Nguyên tử khác có khối lượng bằng bao nhiêu đơn vị cacbon thì nặng bằng bấy nhiêu lần nguyên tử hidro.
- Giữa hai nguyên tử cacbon và oxi thì nguyên tử cacbon nhẹ hơn (12/16=3/4 lần).
- Chúng ta có thể bỏ bớt chữ đvC sau số trị nguyên tử khối.
Bên cạnh đó, hệ Đo lường Quốc tế Sl còn quy ước 1 đvC = 1/NAg = 1/(1000 NA) kg với NA là hằng số Avogadro.
- 1 đvC = 1.66 x 10-30 tấn
- 1 đvC = 1.66 x 10-29 tạ
- 1 đvC = 1.66 x 10-28 yến
- 1 đvC = 1.66 x 10-27 kg
- 1 đvC = 1.66 x 10-26 hg
- 1 đvC = 1.66 x 10-25 dag
- 1 đvC = 1.66 x 10-24 g
- 1 đvC = 1.66 x 10-21 mg
3. Nguyên tử khối trung bình
Hầu hết các nguyên tố hóa học đều tồn tại dưới dạng hỗn hợp của nhiều đồng vị với tỉ lệ % số nguyên tử xác định. Chính vì thế, nguyên tử khối của các nguyên tố có nhiều đồng vị sẽ là nguyên tử khối trung bình của hỗn hợp các đồng vị có tính đến tỉ lệ % số nguyên tử tương ứng.
Ví dụ: Nguyên tố X có 2 đồng vị A và B. Kí hiệu A,B lần lượt là nguyên tử khối của 2 đồng vị, tỉ lệ % số nguyên tử tương ứng là a và b. Khi đó nguyên tử khối trung bình (Atb) nguyên tố X là:
Atb = (a.A + b.B)/100
Lưu ý: Đối với những phép toán không cần độ chính xác cao, có thể coi nguyên tử khối bằng số khối.
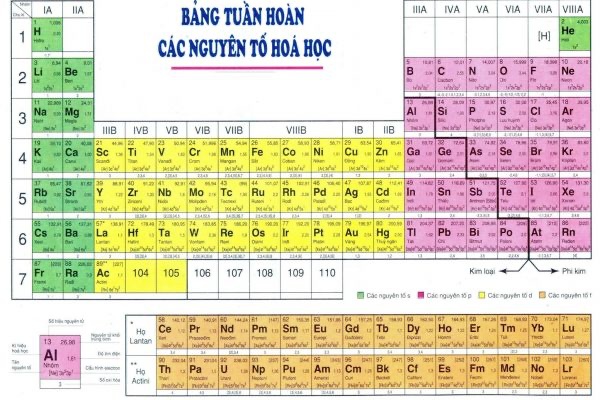
Bảng nguyên tử khối và hoá trị chi tiết nhất
Nhằm giúp các bạn thuận tiện trong quá trình tra cứu và tổng hợp kiến thức. Dưới đây là bảng nguyên tử khối chi tiết của các nguyên tố hóa học:
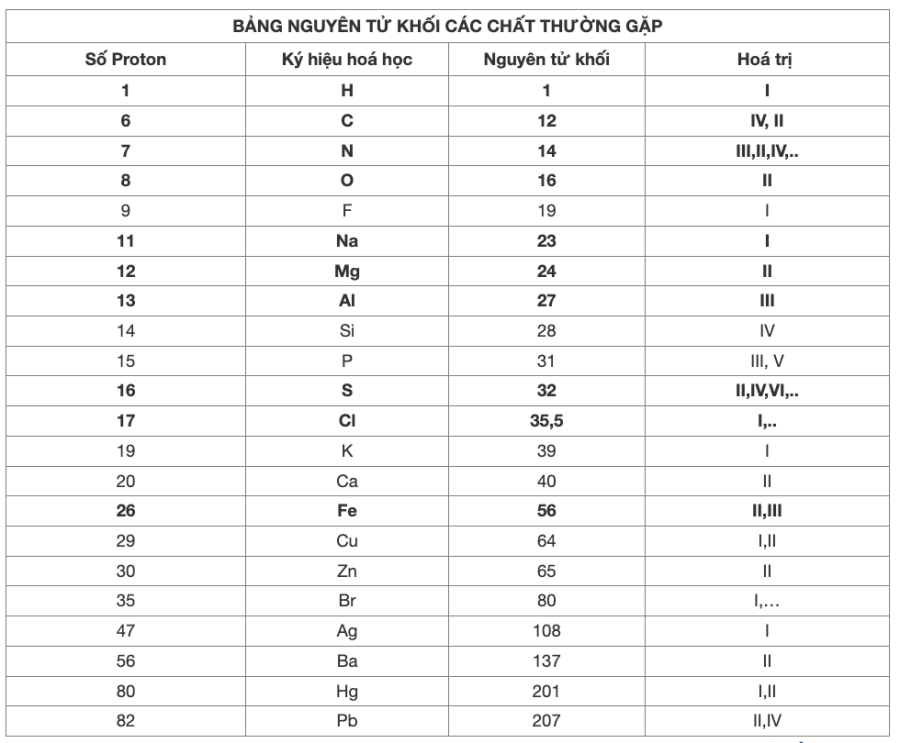
| Số proton | Tên Nguyên tố | Ký hiệu hoá học | Nguyên tử khối | Hoá trị |
| 1 | Hiđro | H | 1 | I |
| 2 | Heli | He | 4 | |
| 3 | Liti | Li | 7 | I |
| 4 | Beri | Be | 9 | II |
| 5 | Bo | B | 11 | III |
| 6 | Cacbon | C | 12 | IV, II |
| 7 | Nitơ | N | 14 | II, III, IV… |
| 8 | Oxi | O | 16 | II |
| 9 | Flo | F | 19 | I |
| 10 | Neon | Ne | 20 | |
| 11 | Natri | Na | 23 | I |
| 12 | Magie | Mg | 24 | II |
| 13 | Nhôm | Al | 27 | III |
| 14 | Silic | Si | 28 | IV |
| 15 | Photpho | P | 31 | III, V |
| 16 | Lưu huỳnh | S | 32 | II, IV, VI |
| 17 | Clo | Cl | 35,5 | I,… |
| 18 | Argon | Ar | 39,9 | |
| 19 | Kali | K | 39 | I |
| 20 | Canxi | Ca | 40 | II |
| 24 | Crom | Cr | 52 | II, III |
| 25 | Mangan | Mn | 55 | II, IV, VII… |
| 26 | Sắt | Fe | 56 | II, III |
| 29 | Đồng | Cu | 64 | I, II |
| 30 | Kẽm | Zn | 65 | II |
| 35 | Brom | Br | 80 | I… |
| 47 | Bạc | Ag | 108 | I |
| 56 | Bari | Ba | 137 | II |
| 80 | Thuỷ ngân | Hg | 201 | I, II |
| 82 | Chì | Pb | 207 | II, IV |
| 83 | Bitmut | Bi | 208,9804 | |
| 84 | Poloni | Po | 209 | |
| 85 | Astatin | At | 210 | |
| 86 | Radon | Rn | 222 | |
| 87 | Franxi | Fr | 223 | |
| 88 | Radi | Ra | 226 | |
| 89 | Actini | Ac | 227 | |
| 90 | Thori | Th | 232,03806 | |
| 91 | Protactini | Pa | 231,03588 | |
| 92 | Urani | U | 238,02891 | |
| 93 | Neptuni | Np | 237,0482 | |
| 94 | Plutoni | Pu | 244 | |
| 95 | Americi | Am | 243 | |
| 96 | Curi | Cm | 247 | |
| 97 | Berkeli | Bk | 247 | |
| 98 | Californi | Cf | 251 | |
| 99 | Einsteini | Es | 252 | |
| 100 | Fermi | Fm | 257 | |
| 101 | Mendelevi | Md | 258 | |
| 102 | Nobeli | No | 259 | |
| 103 | Lawrenci | Lr | 262 | |
| 104 | Rutherfordi | Rf | 267 | |
| 105 | Dubni | Db | 268 | |
| 106 | Seaborgi | Sg | [269] | |
| 107 | Bohri | Bh | [270] | |
| 108 | Hassi | Hs | [269] | |
| 109 | Meitneri | Mt | [278] | |
| 110 | Darmstadti | Ds | [281] | |
| 111 | Roentgeni | Rg | [281] | |
| 112 | Copernixi | Cn | [285] | |
| 113 | Nihoni | Nh | [286] | |
| 114 | Flerovi | Fl | [289] | |
| 115 | Moscovi | Mc | [288] | |
| 116 | Livermori | Lv | [293] | |
| 117 | Tennessine | Ts | [294] | |
| 118 | Oganesson | Og | [294] |
Bên cạnh bảng nguyên tử khối của các nguyên tố ở trên, bạn hãy ghi nhớ thêm khối lượng của một số nhóm axit, gốc axit phổ biến dưới đây:
|
STT
|
Tên nhóm
|
CTHH
|
Nguyên tử khối
|
|
1
|
Hidroxit
|
-OH
|
17
|
|
2
|
Clorua
|
-Cl
|
35.5
|
|
3
|
Bromua
|
-Br
|
80
|
|
4
|
Iotdua
|
-I
|
127
|
|
5
|
Nitrit
|
-NO2
|
46
|
|
6
|
Nitrat
|
-NO3
|
62
|
|
7
|
Sunfua
|
=S
|
32
|
|
8
|
Sunfit
|
=SO3
|
80
|
|
9
|
Sunfat
|
=SO4
|
96
|
|
10
|
Cacbonat
|
=CO3
|
60
|
|
11
|
Photphit
|
≡PO3
|
79
|
|
12
|
Photphat
|
≡PO4
|
95
|
|
13
|
Hidrophotphat
|
=HPO4
|
96
|
|
14
|
Dihidrophotphat
|
-H2PO4
|
97
|
|
15
|
Hidrophotphit
|
=HPO3
|
80
|
|
16
|
Dihidrophotphit
|
-H2PO3
|
81
|
|
17
|
Hidro Sunfat
|
-HSO4
|
97
|
|
18
|
Hidrosunfit
|
-HSO3
|
81
|
|
19
|
Hidrosunfua
|
-HS
|
33
|
|
20
|
Hidrocacbonat
|
-HCO3
|
61
|
|
21
|
Silicat
|
=SiO3
|
76
|
Cách tính khối lượng thực của nguyên tử
Bởi vì khối lượng của các nguyên tử được tính bằng gram là quá nhỏ nên không thể dễ dàng tính toán. Do đó, người ta đã quy ước lấy 1/12 khối lượng nguyên tử C để làm đơn vị nguyên tử (đvC).
Trên thực tế, bạn cũng có thể tính khối lượng thực (h) của nguyên tử theo đơn vị gram. Cách thực hiện như sau:
- Bước 1: Đầu tiên, bạn cần nắm rõ 1đvC = 1,6605.10-27 kg =1,6605.10-24 g
- Bước 2: Sau đó, tiến hành tra cứu bảng nguyên tử khối của những nguyên tố hóa học. Ví dụ như nguyên tố A có nguyên tử khối là a, tức A = a.
- Bước 3: Khi đó, khối lượng thực của nguyên tử A là: mA = a . 0,166 .10-23 g. Còn khối lượng thực của nguyên tử A là: mA = a . 0,166 .10-23 g
Ví dụ: Cho 16g oxy. Xác định nguyên tử oxy có trong 16g oxy và tính khối lượng nguyên tử đó.
Giải: Áp dụng công thức tính nguyên tử khối, ta có:
Số nguyên tử = Khối lượng tính bằng g/Khối lượng tính bằng g của 1 nguyên tử
=> Số nguyên tử trong 16g oxi được xác định là: 16 / (16.1,6605.10-24) = 6,02.10-23
1mol oxi có khối lượng 16g = 16(đvC) thì 1 nguyên tử oxi sẽ có khối lượng là 16.1,6605.10 -24 g
Mẹo ghi nhớ bảng nguyên tử khối đơn giản, nhanh chóng
Bởi vì có đến hơn 100 nguyên tố hoá học nên việc ghi nhớ bảng nguyên tử khối chắc chắn không phải là điều dễ dàng. Chính vì thế, bạn nên ưu tiên học thuộc những nguyên tố phổ biến trước sau đó mở rộng những nguyên tố ít gặp hơn. Một số mẹo để ghi nhớ bảng nguyên tử khối hóa học đơn giản bạn có thể áp dụng.
1. Thường xuyên làm nhiều bài tập hoá học
Làm nhiều bài tập hoá học được đánh giá là cách ghi nhớ và lưu trữ kiến thức về nguyên tử khối lâu bền. Do đó, bạn hãy cố gắng làm nhiều bài tập thường xuyên, thậm chí là làm đi làm lại nhiều lần.
Ngoài ra, Hoá học cũng là một môn rất đa dạng về bài tập. Thông thường, mỗi bài tập Hóa sẽ cho sẵn thông tin về nguyên tử khối. Nhờ đó, trong quá trình làm bài bạn vừa có thể ôn tập được kiến thức, vừa có cơ hội cho trí não rèn luyện khả năng ghi nhớ.
2. Học qua bài ca nguyên tử khối
Học qua bài ca nguyên tử khối cũng là một cách ghi nhớ được nhiều thầy cô giới thiệu cho học sinh của mình. Ưu điểm nổi bật của phương pháp này chính là rút ngắn thời gian học một cách đáng kể, mang lại hiệu quả cao và góp phần khiến môn Hóa thêm thú vị. Từ đó, các bạn học sinh cũng có thêm cảm hứng, động lực học Hóa hơn.
Một số bài thơ nguyên tử khối được lưu truyền nhiều nhất qua các thế hệ học sinh:
Bài thơ nguyên tử khối số 1
Hidro số 1 bạn ơi
Liti số 7 nhớ ngay dễ dàng
Cacbon thì nhớ 12
Nito 14 bạn thời chớ quên
Oxy 16 trăng lên
Flo 19 vấn vương riêng sầu
Bài thơ nguyên tử khối số 2
“Hidro là 1
12 cột Cacbon
Nitơ 14 tròn
Oxi trăng 16
Natri hay láu táu
Nhảy tót lên 23
Khiến Magie gần nhà
Ngậm ngùi nhận 24
27 nhôm la lớn
Lưu huỳnh giành 32
Khác người thật là tài
Clo 35 rưỡi
Kali thích 39
Canxi tiếp 40
55 Mangan cười
Sắt đây rồi 56
64 đồng nổi cáu
Vì kém kẽm 65
80 brom nằm
Xa bạc 108
Bari thì chán ngán
137 ích chi
Kém người ta còn gì
Thuỷ ngân 201
Còn lại chì một cột
207 thật to
Heli thì buồn so
Mình đây được có 4
Liti thật khiêm tốn
Số 7 là được rồi
Số 9 Beri ngồi
Trêu bạn Bo 11
19 đây chết ngột
Flo đang than phiền
Neon thì cười hiền
Tớ 20 tròn chẵn
Silic người đứng đắn
Nhân 28 đẹp ko
Photpho đỏ hồng hồng
Nhận 31 cuối tháng
Agon cười trong sáng
39,9 đây
Kết thúc bài ca này
Crom 52 đấy”
Bài thơ nguyên tử khối số 3
“Hai ba Natri (Na=23)
Nhớ ghi cho rõ
Kali chẳng khó
Ba chín dễ dàng (K=39)
Khi nhắc đến Vàng
Một trăm chín bảy (Au=197)
Oxi gây cháy
Chỉ mười sáu thôi (O=16)
Còn Bạc dễ rồi
Một trăm lẻ tám (Ag =108)
Sắt màu trắng xám
Năm sáu có gì (Fe=56)
Nghĩ tới Beri
Nhớ ngay là chín (Be=9)
Gấp ba lần chín
Là của anh Nhôm (Al=27)
Còn của Crôm
Là năm hai đó (Cr=52)
Của Đồng đã rõ
Là sáu mươi tư (Cu =64)
Photpho không dư
Là ba mươi mốt (P=31)
Hai trăm lẻ một
Là của Thủy Ngân (Hg=201)
Chẳng phải ngại ngần
Nitơ mười bốn (N=14)
Hai lần mười bốn
Silic phi kim (Si=28)
Can xi dễ tìm
Bốn mươi vừa chẵn (Ca=40) Mangan vừa vặn
Con số năm lăm (Mn=55)
Ba lăm phẩy năm
Clo chất khí (Cl=35.5)
Phải nhớ cho kỹ
Kẽm là sáu lăm (Zn=65)
Lưu huỳnh chơi khăm
Ba hai đã rõ (S=32)
Chẳng có gì khó
Cacbon mười hai (C=12)
Bari hơi dài
Một trăm ba bảy (Ba=137)
Phát nổ khi cháy
Cẩn thận vẫn hơn
Khối lượng giản đơn
Hiđrô là một (H=1)
Còn cậu Iốt
Ai hỏi nói ngay
Một trăm hai bảy (I=127)
Nếu hai lẻ bảy
Lại của anh Chì (Pb =207)
Brôm nhớ ghi
Tám mươi đã tỏ (Br = 80)
Nhưng vẫn còn đó
Magiê hai tư (Mg=24)
Chẳng phải chần chừ
Flo mười chín (F=19).
(Nguồn: Sưu tầm Internet)”
Bài thơ nguyên tử khối số 4
“Hiđro số 1 khởi đi
Liti số 7 ngại gì chí trai
Cacbon bến nước 12
Nitơ 14 tuổi ngày hoa niên
Oxi 16 khuôn viên
Flo 19 lòng riêng vương sầu
Natri 23 xuân đầu
Magie 24 mong cầu mai sau
Nhôm thời 27 chí cao
Silic 28 lòng nào lại quên
Photpho 31 lập nên
32 nguyên tử khối tên Lưu huỳnh
Clo 35,5 tự mình
Kali 39 nhục vinh chẳng màn
Canxi 40 thẳng hàng
52 Crom chuỗi ngày tàn phải lo
Mangan song ngũ (55) so đo
Sắt thời 56
Coban 59 cồng kềnh
Kẽm đồng 60 lập nền có dư
Đồng 63,6
Kẽm 65,4
Brom 80 chín thư riêng phần
Stronti 88 đồng cân
Bạc 108 tăng lần số sai
Catmi một bách mười hai(112)
Thiếc trăm mười chín(119) một mai cuộc đời
Iot 127 chẳng rời
Bari 137 sức thời bao lâm
Bạch kim 195
Vàng 197 tiếng tăng chẳng vừa
Thủy ngân 2 bách phẩy 0 thừa (200,0)
Chì 2 linh 7 (207) chẳng ưa lửa hồng
Rađi 226 mong
Bismut 2 trăm linh 9 cứ trông cậy mình (209)
Bài thơ nguyên tử phân minh
Lòng này đã quyết tự tin học hàn”

Một số dạng bài tập cơ bản ứng dụng bảng nguyên tử khối hóa học
Với tính ứng dụng cao, bảng nguyên tố hoá học được vận dụng trong hầu hết những bài tập Hoá học, đặc biệt là Hoá vô cơ. Dưới đây là 2 trong số những dạng bài cơ bản dùng bảng nguyên tử khối để giải quyết nhanh gọn:
1. Tìm nguyên tố trong hợp chất
Đây là dạng bài đầu tiên cũng như được xem là thông dụng nhất khi bạn lần đầu tiên làm quen với môn Hoá. Do đó, đề bài thông thường sẽ cho sẵn công thức và phân tử khối của một số hợp chất. Tuy nhiên, sẽ để khuyết 1 nguyên tố trong hợp chất đó (thường ký hiệu nguyên tố này là A hoặc X).
Khi đó, nhiệm vụ của bạn là áp dụng phép tính phù hợp đề tìm ra khối lượng của nguyên tố đang cần tìm. Sau đó, theo trí nhớ về bảng nguyên tử khối, suy ra nguyên tố ấy là gì.
Ví dụ: Hợp chất của kim loại A kết hợp với axit (H2SO4) tạo ra muối có công thức là (ASO4). Tổng phân tử khối của hợp chất này là 160 đvC. Xác định nguyên tố A.
Giải: Trên bảng nguyên tử khối ta thấy:
- Nguyên tử khối của S là: 32
- Nguyên tử khối của oxy là: 16
Theo công thức hợp chất ta có A + 32 + 16 x 4 = 160
=> A = 64. Mà 64 là nguyên tử khối của Đồng. Vậy nguyên tố cần tìm là Cu.
2. Tìm nguyên tố khi biết nguyên tử khối
Dạng bài “Tìm nguyên tố khi biết nguyên tử khối” thường có phần đơn giản hơn dạng 1 và hay xuất hiện trong các câu hỏi trắc nghiệm.
Cụ thể, với dạng bài này, đề bài thường cho sẵn dữ kiện về khối lượng của nguyên tố A. Sau đó, yêu cầu xác định nguyên tố A đó là gì? Những dữ liệu phổ biến nhất là so sánh chúng hơn/kém như thế nào với một nguyên tố khác.
Vậy nên đối với những dạng bài này, đòi hỏi các bạn học sinh phải thuộc lòng bảng nguyên tử khối hóa học để có thể liên kết chúng lại với nhau. Từ đó mới có thể tính toán thật nhanh để đưa ra đáp án nguyên tố cần tìm.
Ngoài ra, bạn cũng nên xây dựng kế hoạch học tập rõ ràng, dành nhiều thời gian rèn luyện môn Hóa. Đặc biệt, hãy kết hợp giải bài tập sách giáo khoa môn Hóa 8 sẽ giúp các bạn cải thiện năng lực nhanh nhất.
Bài tập củng cố về nguyên tử khối
Những bài tập về nguyên tử khối được INVERT tổng hợp dưới đây sẽ giúp cho các bạn học sinh củng cố kiến thức vừa học, nắm chắc bài hơn. Đồng thời, còn tạo nền tảng kiến thức tốt để các bạn có thể học lý thuyết nhanh chóng trong các bài tiếp theo.
Bài 1: Hãy so sánh xem nguyên tử magie nặng hay nhẹ hơn bao nhiêu lần so với nguyên tử cacbon?
Bài 2: Nguyên tử X nặng gấp 4 lần nguyên tử nitơ. Tính nguyên tử khối của X và cho biết X thuộc nguyên tố nào?
Bài 3: Biết nguyên tử nhôm có 13 proton, 14 nơtron. Khối lượng tính bằng gam của một nguyên tử nhôm là
A. 5,32.10-23g.
B. 6,02.10-23g.
C. 4,48.10-23g.
D. 3,99.10-23g.
Bài 4: Biết rằng bốn nguyên tử Mg nặng bằng ba nguyên tử của nguyên tố X. Vậy tên của nguyên tố X là
A. Lưu huỳnh.
B. Sắt.
C. Nitơ.
D. Can xi.
Bài 5: Khối lượng của một nguyên tử cacbon là 19,9265. 10-23 gam. Vậy ta có khối lượng của 1 đvC là
A. 8,553. 10-23 g.
B. 2,6605. 10-23 g.
C. 0,16605. 10-23 g.
D. 18,56. 10-23 g.
Bài 6: Biết nguyên tử nitơ gồm có 7 proton, 7 nơtron và 7 electron. Khối lượng của toàn nguyên tử nitơ là
A. 14 gam.
B. 21 gam.
C. 2,34. 10-23 gam.
D. 2,34. 10-27 gam.
Bài 7: Khối lượng tương đối của một phân tử H2O là
A. 18 đvC.
B. 18 gam.
C.34 đvC.
D. 18kg.
Bài 8: Hai nguyên tử Mg nặng gấp mấy lần nguyên tử O?
A. 1.
B. 2.
C. 3.
D. 4.
Bài 9: Một nguyên tử chỉ có 1 electron ở vỏ nguyên tử. Hạt nhân nguyên tử có khối lượng xấp xỉ 3u. Số hạt proton và hạt nơtron trong hạt nhân nguyên tử này lần lượt là
A. 1 và 0.
B. 1 và 2.
C. 1 và 3.
D. 3 và 0.
Bài 10: Trường hợp nào đưới đây có sự tương ứng giữa hạt cơ bản với khối lượng và điện tích của chúng?
A. proton, m = 0,00055u, q = 1+.
B. nơtron, m = 1,0086u, q = 0.
C. electron, m = 1,0073u, q =1-.
D. proton, m = 1,0073u, q = 1-.
Trên đây là một số kiến thức về bảng nguyên tử khối mà đội ngũ INVERT chúng tôi đã tổng hợp được. Mong rằng thông qua bài viết này các bạn hoàn toàn có thể biết được bảng nguyên tử khối và vận dụng để tính dễ dàng. Nếu có gì thắc mắc bạn cũng có thể bình luận bên dưới, chúng tôi sẽ giải đáp cho bạn. Chúc các bạn đạt được điểm số cao.
Tags:
bảng nguyên tử khối lớp 8nguyên tử khối cunguyên tử khối s

