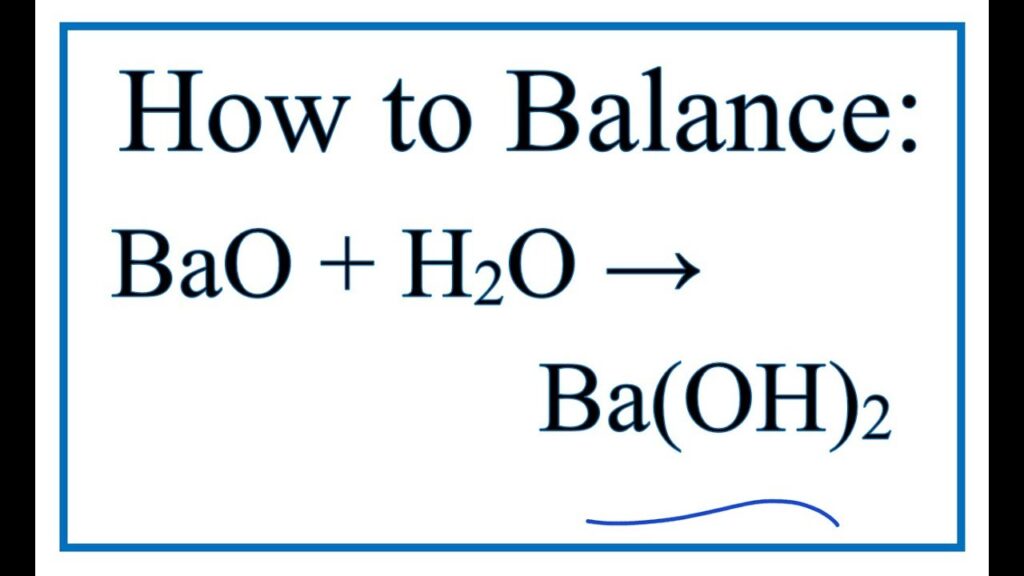
1. Phương trình phản ứng BaO tác dụng với H2O:
BaO + H2O → Ba(OH)2
(Đây là phản ứng thuộc loại phản ứng hóa hợp).
Các viết phương trình hóa học phản ứng của BaO tác dụng với H2O:
Bước 1: Viết phương trình phân tử: BaO + H2O → Ba(OH)2
Bước 2: Đếm số nguyên tử mỗi nguyên tố trong 2 vế của phương trình hóa học.
Bước 3: Đặt hệ số sao cho số nguyên tử ở mỗi nguyên tố ở 2 vế bằng nhau.
Bước 4: Hoàn thành phương trình hóa học: BaO + H2O → Ba(OH)2
2. Phân tích phương trình phản ứng hóa học:
Thứ nhất, hiện tượng của phản ứng BaO tác dụng với H2O: Chất rắn oxit axit tan dần trong nước và dung dịch thu được làm quỳ tím chuyển sang màu xanh.
Thứ hai, cách tiến hành phản ứng BaO tác dụng với H2O: Cho 1 gam BaO vào cốc có chứa 10ml nước với nhiệt độ thường
3. Bài tập vận dụng có liên quan:
Câu 1: Oxit nào tan trong nước tạo thành dung dịch bazơ?
A. CO2
B. SO2
C. Na2O
D. NO2
Câu 2: Cho các Oxit sau CuO, Fe2O3, N2O5, CO2, CaO. Số oxit tác dụng với nước là:
A. 2
B. 3
C. 4
D. 5
Câu 3: Oxit khi tan trong nước làm cho quỳ tím chuyển thành màu đỏ là:
A. CuO
B. BaO
C. MgO
D. SO2
Câu 4: Căn cứ vào tính chất hóa học của ô xít, người ta phân oxit thành bao nhiêu loại?
A. 1
B. 2
C. 3
D. 4
Câu 5: Cho các oxit sau CO2, K2O, CaO, BaO, P2O5. Oxit tác dụng với axit để tạo thành muối và nước là:
A. CO2, CaO, BaO
B. K2O, CaO, BaO
C. K2O, CaO, P2O5
D. CO2, BaO, P2O5
Câu 6: Oxit lưỡng tính là
A. Những oxit tác dụng với dung dịch bazơ và tác dụng với dung dịch axit tạo thành muối và nước.
B. Những oxit không tác dụng với axit, bazơ, nước.
C. Những oxit tác dụng với axit tạo thành muối và nước.
D. Những oxit tác dụng với bazo tạo thành muối và nước.
Câu 7: Cho m gam magie oxit tác dụng với dung dịch HCl, sau phản ứng thu được 9,5 gam gam MgCl2 và nước. Giá trị của M là
A. 4 gam
B. 5 gam
C. 6 gam
D. 7 gam
Câu 8: Cho các phát biểu sau
(1) oxit là hợp chất của 2 nguyên tố, trong đó có 1 nguyên tố là oxi.
(2) oxit trung tính là những oxit không tác dụng với axit, bazơ và nước.
(3) Oxit NO2 khi tan trong nước làm giấy quỳ tím chuyển thành màu xanh.
(4) Dung dịch axit tạo thành khi cho P2O5 tác dụng với nước là: H3PO4
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Câu 9: Phương trình phản ứng khi cho Na2O tác dụng với H2SO4 là
A. Na2O + H2SO4 → Na2SO4 + H2O
B. Na2O + H2SO4 → NaSO4 + H2O
C. 2Na2O + H2SO4 → Na2SO4 + H2O
D. Na2O + 4H2SO4 → Na2(SO4)3 + 2H2O
Câu 10: Hai oxit tác dụng với nhau tạo thành muối là
A. Na2O và K2O
B. CO2 và NO2
C. Na2O và CO2
D. BaO và CuO
Câu 11: Sục khí SO2 vào cốc đựng nước cất, cho quỳ tím vào dung dịch thu được, quỳ tím sẽ:
A. chuyển màu đỏ.
B. chuyển màu xanh.
C. chuyển màu vàng.
D. mất màu.
Câu 12: Dãy các chất nào sau đây tan trong nước?
A. CaO, BaO, Al2O3, CuO
B. CuO, Al2O3, K2O, Na2O
C. Na2O, CO2, SO3, K2O
D. CO2, CuO, Na2O, FeO
Câu 13: Cặp chất tác dụng với nhau sẽ tạo ra khí lưu huỳnh đioxit:
A. CaCO3 và HCl
B. Na2SO3 và H2SO4
C. CuCl2 và KOH
D. K2CO3 và HNO3
Câu 14: Hòa tan 2,4 gam oxit của một kim loại hóa trị II vào 21,9 gam dung dịch HCl 10% thì vừa đủ. Oxit đó là:
A. CuO
B. CaO
C. MgO
D. FeO
Câu 15: Dãy các chất tác dụng với lưu huỳnh đioxit là:
A. Na2O, CO2, NaOH, Ca(OH)2
B. CaO, K2O, KOH, Ca(OH)2
C. HCl, Na2O, Fe2O3, Fe(OH)3
D. Na2O, CuO, SO3, CO2
4. Đáp án và hướng dẫn lời giải:
Câu 1: Đáp án: C
Na2O
Oxit axit là CO2, SO2, NO2
Oxit bazơ là: Na2O
Oxit bazơ tác dụng với nước tạo ra dung dịch bazơ
Na2O + H2O → 2NaOH
Câu 2: Đáp án: B
3 Oxit tác dụng với nước là N2O5, CO2, CaO
N2O5 + H2O → 2HNO3
CO2 + H2O → H2CO3
CaO + H2O → Ca(OH)2
Câu 3: Đáp án: D
SO2. Oxit axit là: SO2 khi tác dụng với nước tạo thành dung dịch axit, dung dịch axit làm xho quỳ tím hóa đỏ.
SO2 + H2O → H2SO3
Câu 4: Đáp án: D
Căn cứ vào tính chất hóa học của ô xít, người ta phân loại oxit thành 4 loại:
+Oxit bazơ
+ Oxit axit
+ Oxit lưỡng tính
+ Oxit trung tính
Câu 5:
Đáp án: B.
K2O, CaO, BaO
Oxit bazo tác dụng với axit tạo thành muối và nước.
Oxit bazơ là: K2O, CaO, BaO
Câu 6: Đáp án: A.
Oxit lưỡng tính là những oxit tác dụng với dung dịch bazơ và tác dụng với dung dịch axit tạo thành muối và nước.
Câu 7: Đáp án: A
4 gam
Số mol của MgCl2 là: nMgCl2 = 9,5/9,5 = 0,1 (mol)
Phương trình phản ứng hóa học:
MgO + 2HCl = MgCl2 + 2H2O
0,1 0,1 (mol)
Theo phương trình phản ứng, ta có nMgO = nMgCl2 = 0,1 mol
Vậy khối lượng của MgO cần tìm là: m = 0,1.40 = 4 gam.
Câu 8: Đáp án: C
Số phát biểu đúng là: (1), (2), (4)
Phát biểu (3) sai, vì khi cho oxit NO2 tác dụng với nước thu được dung dịch axit làm quỳ tím chuyển sang màu đỏ.
Câu 9: Đáp án: A
Na2O + H2SO4 → Na2SO4 + H2O
Câu 10: Đáp án: C
Na2O và CO2
Na2O + CO2 → Na2CO3
Câu 11: Đáp án: A
Chuyển màu đỏ
Câu 12: Đáp án: C
Na2O, CO2, SO3, K2O
Câu 13: Đáp án: B
Na2SO3 và H2SO4
Câu 14: Đáp án: A
CuO
Câu 15: Đáp án: B
CaO, K2O, KOH, Ca(OH)2
5. Tìm hiểu thêm về Oxit bazo:
5.1. Oxit bazơ là gì?
Khái niệm oxit bazo được hiểu một cách đơn giản nhất, nó biểu thị sự kết hợp giữa nguyên tử oxi kim loại với các kim loại. Ví dụ: Na2O, K2O, BaO…
Một công thức oxit cơ bản bao gồm một hoặc nhiều nguyên tử kim loại (M) và một hoặc nhiều nguyên tử oxy. Tùy theo hóa trị của kim loại mà có công thức phù hợp, ví dụ kim loại có hóa trị 1 cần 2 nguyên tử kim loại để tạo thành oxit bazơ. Kim loại hóa trị hai chỉ cần một nguyên tử oxy.
5.2. Phân loại oxit bazơ:
Tùy thuộc vào tính chất của phân tử kim loại, oxit bazo được phân thành các loại sau:
‐ Oxit bazơ tan: Chứa các loại kiềm như Na, K, Li… và các kim loại kiềm thổ như Na, Sr, Cs, Li, Ba,…
‐ Oxit bazơ không tan: Chứa các oxit của các kim loại khác như Fe. , Cu,…
Ngoài ra, dựa vào tính chất người ta còn chia ra oxit lưỡng tính và oxit trung tính:
‐ Oxit lưỡng tính là oxit tác dụng với dung dịch axit và dung dịch bazơ tạo thành muối và nước. Thường là Al2O3, ZnO…
‐ Oxit trung tính: là oxit không tác dụng với nước tạo axit, bazơ và không phản ứng với axit, bazơ để tạo thành muối. Ví dụ như NO, CO…
5.3. Tính chất hóa học đặc trưng của oxit bazơ:
Oxit bazơ tác dụng với nước, oxit axit, axit cụ thể là:
‐ Tác dụng với H2O:
Chỉ có oxit kim loại kiềm bazơ và kim loại kiềm thông thường phản ứng với nước. Như vậy chúng đều tan trong nước gồm: Na2O, CaO, BaO, K2O,… tạo thành các bazơ (kiềm) tan lần lượt là NaOH, Ca(OH)2, Ba(OH)2, KOH.
Na2O + H2O → 2NaOH
BaO + H2O → Ba(OH)2
K2O + H2O → 2KOH
Sản phẩm thu được sau phản ứng là NaOH, KOH,… làm quỳ tím chuyển màu.
– Phản ứng với axit
Hầu hết các oxit bazơ đều phản ứng với axit để tạo thành muối và nước. Công thức chung được biểu diễn như sau: Oxit bazơ + Axit → Muối + H2O.
Na2O + H2SO4 → Na2SO4 + H2O
CuO + 2HCl → CuCl2 + H2O
‐ Phản ứng với oxit axit
Một số oxit bazơ cũng phản ứng với oxit axit để tạo thành muối. Nói chung, đây là những oxit bazơ phản ứng với nước dưới dạng oxit kiềm để tạo thành muối tan trong nước. Còn có tác dụng với nước tạo thành muối không tan thường là oxit kiềm thổ.
Công thức như sau: Oxit bazo + Oxit axit → Muối.
Cụ thể như:
Na2O + CO2 → Na2CO3
BaO + CO2 → BaCO3↓
5.4. Ứng dụng của Oxit bazơ trong cuộc sống:
Oxit bazơ rất quan trọng và được ứng dụng rộng rãi trong thực tế đời sống lọc nước bể bơi, sản xuất dược phẩm, xử lý vải thô,… Cụ thể:
Công nghiệp hóa chất và dược phẩm: được sử dụng để sản xuất các sản phẩm natri và làm chất tẩy trắng hoặc khử trùng.
Trong phòng thí nghiệm: Hóa học cần thiết cho học tập và nghiên cứu.
Trong công nghiệp thực phẩm: Pha chế dung dịch kiềm, xử lý rau quả trước khi chế biến hoặc bảo quản.
Sử dụng trong ngành dệt may: Dùng để xử lý vải thô, nhuộm và phân hủy pectin và sáp, giúp vải dễ hấp thụ thuốc nhuộm và lên màu đẹp nhất.
Xử lý nước, đặc biệt là bể bơi: Các oxit kiềm hòa tan trong nước làm tăng độ pH. Ngoài ra, oxit kiềm còn được dùng để trung hòa và loại bỏ cặn bẩn bám trên đường ống nước sinh hoạt.
Ứng dụng trong ngành dầu khí: Cơ sở cân bằng PH cho dung dịch khoan, loại bỏ lưu huỳnh và các hợp chất chứa lưu huỳnh hoặc các hợp chất axit trong lọc dầu. Trong nghiên cứu hiện đại, hạt nano oxit kim loại có nhiều ứng dụng như vi điện tử, năng lượng, lưu trữ, làm sạch môi trường, phát hiện khí, sản xuất gốm sứ, y sinh…
Ngoài ra còn một số oxit quan trọng được ứng dụng trong đời sống như:
Ôxít magie (MgO) – là chất dẫn nhiệt và cách điện tốt được sử dụng trong gạch chịu lửa và chất cách điện.
Một oxit khác là canxi oxit (CaO) hay còn gọi là vôi tôi, được sử dụng rộng rãi trong công nghiệp luyện thép và xử lý nước.
Các oxit sắt phổ biến, được sử dụng rộng rãi vì rẻ tiền và đóng vai trò quan trọng trong nhiều quá trình sinh học và địa chất. Oxit sắt được con người sử dụng rộng rãi làm quặng sắt trong mối, chất xúc tác, chất màu bền (lớp phủ, sơn và bê tông màu), và huyết sắc tố.