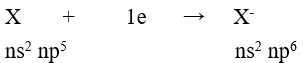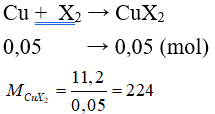Brom là gì? Tính chất, hợp chất, cách điều chế và ứng dụng? là tài liệu vô cùng bổ ích giúp quý độc giả tiết kiệm thời gian và công sức làm việc. Sau đây là nội dung chi tiết mời các bạn cùng tham khảo.
1. Brom là gì?
Brom là một nguyên tố thuộc nhóm Halogen, nổi tiếng với nhiều ứng dụng hữu ích. Trạng thái tự nhiên của Brom đã được nghiên cứu và Brom hiện thể hiện những đặc tính vật lý và hóa học độc đáo. Chúng ta sẽ tìm hiểu về tính chất này cũng như một số hợp chất của nó. Cách điều chế Brom cũng sẽ được trình bày.
Brom được sử dụng rộng rãi trong nhiều lĩnh vực, bao gồm làm phẩm nhuộm và chế tạo bromua bạc cho việc tráng lên phim ảnh. Bên cạnh các ứng dụng này, còn có những lĩnh vực khác mà Brom đóng một vai trò quan trọng. Chúng ta sẽ khám phá thêm về những ứng dụng này sau trong bài viết. Ngoài ra, chúng ta cũng sẽ xem xét các khía cạnh khác của nguyên tố này như tính chất và cách điều chế.
Brom tồn tại chủ yếu dưới dạng hợp chất trong tự nhiên, có khả năng phản ứng mạnh nên không thường được tìm thấy ở dạng nguyên chất. Các hợp chất brom thường có màu nâu đỏ và phổ biến nhất là các muối bromua của kali, natri, và magie. Chúng được tìm thấy trong nước biển, hồ, sông, và thường xuất hiện nhiều trong vùng biển chết.
2. Tính chất của Brom:
Tính chất vật lý: Brom có dạng chất lỏng màu nâu đỏ, có khả năng bay hơi, mùi khá khó chịu và độc.
Tính chất hoá học:
- Tác dụng với kim loại: Khi được đun nóng, Brom oxi hóa được nhiều kim loại và tạo ra muối tương ứng, ví dụ:
Br2 + 2Al → 2AlBr3
- Tác dụng với Hidro: Ở nhiệt độ cao, Brom oxi hóa được Hidro và tạo thành bromua:
Br2 + H2 → 2HBr
Khí HBr tan trong nước để tạo thành dung dịch axit bromhidric, một loại axit mạnh hơn axit clohiđric.
- Tác dụng với nước: Khi Brom tan trong nước, một phần của nó phản ứng chậm với nước tạo ra axit HBr và axit HBrO. Đây là một phản ứng thuận nghịch:
Br2 + H2O ⇌ HBr + HBrO
- Tính khử của Br2 và HBr: Brom có tính khử khi tiếp xúc với chất oxi hóa mạnh, như nước clo, ví dụ:
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
HBr cũng có tính khử mạnh hơn HCl. HBr có khả năng khử H2SO4 đặc thành SO2:
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
Dung dịch HBr ban đầu không màu, nhưng nếu để lâu trong không khí, nó sẽ trở nên có màu vàng nâu do bị oxi hóa:
4HBr + O2 → 2H2O + 2Br2
3. Một số hợp chất của Brom:
Hidro bromua và axit bromhidric
HBr, ở điều kiện nhiệt độ thông thường, tồn tại dưới dạng khí, không có màu, có khả năng tạo khói trong không khí độ ẩm và dễ tan trong nước. Khi HBr hòa tan trong nước, ta thu được dung dịch gọi là axit bromhiđric, một axit mạnh.
Hợp chất chứa oxi của brom
Trong số các hợp chất oxi hóa của brom, axit hipobromo (HBrO) được xem xét có tính bền, tính oxi hóa và tính axit thấp hơn so với axit clo (HClO). Các hợp chất bromic bao gồm axit bromic (HBrO3) và axit pebromic (HBrO4). Tương tự như clo, brom cũng có khả năng thể hiện nhiều trạng thái số oxi hóa khác nhau (+1, +3, +5, +7) trong các hợp chất với oxi.
4. Điều chế Brom như thế nào?
Brom là một hợp chất quan trọng được sản xuất chủ yếu từ nước biển. Quá trình sản xuất này bao gồm việc tách muối ăn (NaCl) khỏi nước biển, trong đó còn chứa các muối bromua của kali và natri. Sau đó, một quá trình sục khí clo qua dung dịch được thực hiện. Cuối cùng, dung dịch này được chưng cất để bay hơi brom, sau đó ngưng tụ lại.
5. Brom có những ứng dụng gì?
Brom có nhiều ứng dụng đa dạng nhờ tính chất đặc trưng của nó:
- Chất chống cháy: Brom được sử dụng như một chất chống cháy, giúp ngăn chặn hoặc làm chậm quá trình phát lửa do chất dẻo.
- Nông nghiệp: Các hợp chất brom hữu cơ được sử dụng làm thuốc trừ sâu, thuốc diệt cỏ và diệt các loài gây hại trong nông nghiệp.
- Phụ gia xăng dầu: Brom cũng được dùng làm phụ gia trong ngành công nghiệp dầu khí, mặc dù lượng sử dụng đã có xu hướng giảm dần gần đây.
- Khử trùng bể bơi: Một ứng dụng ít biết đến của Brom là trong việc khử trùng bể bơi mái che, nơi nó thường hiệu quả hơn so với các loại thuốc khử trùng khác.
- Dược phẩm, sản xuất thuốc nhuộm và in ấn: Brom được sử dụng trong ngành dược phẩm, sản xuất thuốc nhuộm, và mực in, cũng như trong quá trình làm thuốc hiện hình trong nghệ thuật ảnh.
- Khoan dầu: Hợp chất bromua dạng lỏng được sử dụng làm dung dịch khoan trong việc khoan dầu ở các giếng sâu và có áp suất cao
Để mua Brom đảm bảo chất lượng, có một số điểm cần xem xét. Trên
Một lựa chọn tốt để giải quyết vấn đề này và đảm bảo chất lượng của sản phẩm là liên hệ với Trung Sơn. Trung Sơn đã có nhiều năm kinh nghiệm trong việc cung cấp hoá chất và các thiết bị tương tự, và được nhiều khách hàng tin dùng. Chắc chắn rằng họ sẽ mang đến cho bạn sản phẩm Brom chất lượng và không làm bạn thất vọng.
Nhờ qua bài viết này, bạn đã có cái nhìn tổng quan về nguyên tố Brom và các khía cạnh cơ bản liên quan đến nó, bao gồm các tính chất, phương pháp điều chế và ứng dụng.
6. Bài tập vận dụng:
Câu 1: Tính oxi hóa của Br2
A. mạnh hơn Flo nhưng yếu hơn Clo.
B. mạnh hơn Clo nhưng yếu hơn Iot.
C. mạnh hơn Iot nhưng yếu hơn Clo.
D. mạnh hơn Flo nhưng yếu hơn Iot.
Lời giải:
Đáp án C
Tính oxi hóa giảm dần theo thứ tự Flo → Clo → Brom → Iot.
Câu 2: Trong phản ứng hóa học sau: SO2 + Br2 + 2H2O → H2SO4 + 2HBr. Brom đóng vai trò là
A. chất khử.
B. vừa là chất oxi hóa vừa là chất khử.
C. chất oxi hóa.
D. không là chất oxi hóa không là chất khử.
Lời giải:
Đáp án C
Số oxi hóa của brom giảm từ 0 xuống -1, do đó Br2 là chất oxi hóa.
Câu 3: Chất khí có thể làm mất màu nước brom ở điều kiện thường là
A. SO2. B. CO2.
C. O2. D. HCl.
Lời giải:
Đáp án A.
Phản ứng xảy ra: SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Trước phản ứng dung dịch brom có màu vàng nâu, các dung dịch thu được sau phản ứng không màu.
Câu 4: Trong hợp chất, nguyên tố Flo thể hiện số oxi hóa là
A. 0. B. +1.
C. -1. D. +3.
Lời giải:
Đáp án C
Nguyên tố Flo có độ âm điện lớn nhất nên phi kim có tính oxi hóa mạnh nhất. Trong hợp chất Flo chỉ thể hiện số oxi hóa -1.
Câu 5: Phát biểu nào sau đây là sai
A. Trong tự nhiên, flo chỉ có ở dạng hợp chất.
B. Trong hợp chất, các halogen đều có thể có số oxi hóa: -1, +1, +3, +5, +7.
C. Tính oxi hóa của các halogen giảm dần từ flo đến iot
D. Các halogen khá giống nhau về tính chất hóa học.
Lời giải:
Đáp án B
Trong hợp chất, flo chỉ thể hiện số oxi hóa là -1.
Câu 6: Cấu hình electron lớp ngoài cùng của các ion halogenua (X–) là
A. ns2np4 B. ns2np5
C. ns2np6 D. (n – 1)d10ns2np5
Lời giải:
Đáp án C
Câu 7: Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất halogen?
A. Ở điều kịên thường là chất khí.
B. Tác dụng mạnh với nước.
C. Vừa có tính oxi hoá, vừa có tính khử.
D. Có tính oxi hoá mạnh.
Lời giải:
Đáp án D
Các đơn chất halogen đều có tính oxi hóa mạnh.
Câu 8: Phản ứng giữa hiđro và chất nào sau đây là phản ứng thuận nghịch?
A. Flo. B. Clo.
C. Iot. D. Brom.
Lời giải:
Đáp án C
Câu 9: Cho 1,12 lít (đktc) halogen X2 tác dụng vừa đủ với đồng kim loại thu được 11,2 gam CuX2. Nguyên tố halogen là
A. Flo. B. Clo.
C. Brom. D. Iot.
Lời giải:
Đáp án C
⇒ 64 + 2.MX = 224 ⇒ MX = 80. Vậy X là Brom.
Câu 10: Khi nung nóng, iot rắn chuyển ngay thành hơi, không qua trạng thái lỏng.
A. sự thăng hoa. B. sự bay hơi.
C. sự phân hủy. D. sự ngưng tụ.
Lời giải:
Đáp án A
Quá trình chất chuyển từ trạng thái rắn sang trạng thái hơi, không qua trạng thái lỏng gọi là quá trình thăng hoa.
Câu 11: Số electron lớp ngoài cùng của các nguyên tử F, Br là
A. 7 B. 6
C. 5 D. 4
Lời giải:
Đáp án A
F, Br thuộc nhóm halogen (nhóm VIIA), do đó số electron lớp ngoài cùng là 7.
Câu 12: Thuốc thử để nhận ra iot là
A. hồ tinh bột. B. nước brom.
C. phenolphthalein. D. quì tím.
Lời giải:
Đáp án A
Iot làm xanh hồ tinh bột.
Câu 13: Dẫn từ từ clo vào dung dịch NaI có chứa sẵn một ít hồ tinh bột. Hiện tượng xảy ra là
A. Không hiện tượng.
C. Dung dịch chuyển sang màu xanh.
B. Dung dịch hóa đỏ.
D. Dung dịch xuất hiện kết tủa.
Lời giải:
Đáp án C
Cl2 + 2NaI → I2 + 2NaCl
I2 sinh ra làm xanh hồ tinh bột.
Câu 14: Để tinh chế brom bị lẫn tạp chất clo, người ta dẫn hỗn hợp qua
A. dung dịch NaBr.
B. dung dịch NaI.
C. dung dịch NaCl.
D.dung dịch H2SO4.
Lời giải:
Đáp án A.
Cl2 + 2NaBr → 2NaCl + Br2
Câu 15: Nguyên nhân gây ra bệnh fluorosis (bệnh chết răng) là
A. nguồn thực phẩm bị nhiễm độc thuốc trừ sâu.
B. nguồn nước bị ô nhiễm flo.
C. nước thải có hợp chất chứa oxi của clo vượt quá mức cho phép.
D. người dân không sử dụng kem đánh răng.
Lời giải:
Đáp án B