C6H6 + HNO3 → C6H5NO2 + H2O là phản ứng nitro hóa của benzen (C6H6) với axit nitric (HNO3) để tạo thành nitrobenzen (C6H5NO2) và nước (H2O). Mời các bạn theo dõi thông tin chi tiết về phản ứng dưới đây:
1. Phương trình phản ứng C6H6 + HNO3:
C6H6 + HNO3 → C6H5NO2 + H2O
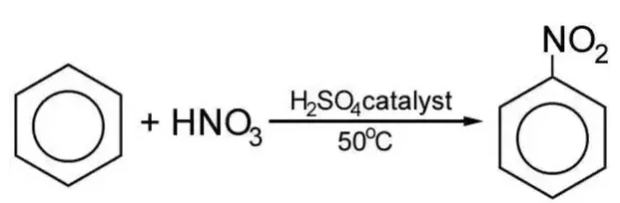
Điều kiện phản ứng: Nhiệt độ, H2SO4
2. Hiện tượng phản ứng giữa C6H6 + HNO3:
Phản ứng bạn đề cập là phản ứng nitro hóa của benzen (C6H6) với axit nitric (HNO3) để tạo thành nitrobenzen (C6H5NO2) và nước (H2O). Đây là một phản ứng quan trọng trong hóa học hữu cơ. Dưới đây là phương trình hoá học của phản ứng:
C6H6 + HNO3 → C6H5NO2 + H2O
Trong phản ứng này, một nhóm nitro (-NO2) thay thế một nguyên tử hydro (-H) trong phân tử benzen. Axit nitric (HNO3) chịu trách nhiệm cung cấp nhóm nitro (-NO2). Phản ứng diễn ra trong môi trường axit và thường được thực hiện ở nhiệt độ cao.
Nitrobenzen (C6H5NO2) là một chất lỏng không màu có mùi đặc trưng. Nó được sử dụng rộng rãi trong sản xuất các hợp chất hữu cơ và là một nguyên liệu quan trọng trong tổng hợp hóa học. Tuy nhiên, nitrobenzen cũng là một chất độc, gây hại cho con người và môi trường. Do đó, việc làm việc với nitrobenzen yêu cầu sự cẩn thận và đúng quy trình an toàn.
3. Phương trình rút gọn của C6H6 + HNO3:
Phương trình hóa học rút gọn cho phản ứng giữa C6H6 (benzen) và HNO3 (axit nitric) có thể được biểu diễn như sau:
C6H6 + HNO3 -> C6H5NO2 + H2O
Trong phản ứng này, benzen (C6H6) tác dụng với axit nitric (HNO3) để tạo thành nitrobenzen (C6H5NO2) và nước (H2O).
4. Bài tập vận dụng liên quan:
Cách cân bằng phương trình:
Để cân bằng phương trình hóa học C6H6 + HNO3 → C6H5NO2 + H2O, chúng ta sẽ làm theo các bước sau:
Bước 1: Xác định số lượng nguyên tử chưa cân bằng trên mỗi phía của phương trình.
Số lượng nguyên tử chưa cân bằng: C6H6: 6 carbon (C) và 6 hydro (H) HNO3: 1 nitơ (N), 3 oxi (O) và 3 hydro (H) C6H5NO2: 6 carbon (C), 5 hydro (H), 1 nitơ (N) và 2 oxi (O) H2O: 2 hydro (H) và 1 oxi (O)
Bước 2: Bắt đầu cân bằng các nguyên tử carbon (C).
Vì chỉ có carbon trong C6H6 và C6H5NO2 nên ta sẽ đặt hệ số 1 trước C6H6 và C6H5NO2:
C6H6 + HNO3 → 1C6H5NO2 + H2O
Bước 3: Cân bằng nguyên tử hydro (H).
Ta có 6 hydro (H) trong C6H6 và 6 hydro (H) trong HNO3, vậy ta không cần điều chỉnh số lượng hydro.
C6H6 + HNO3 → C6H5NO2 + H2O
Bước 4: Cân bằng nguyên tử nitơ (N).
Ta có 1 nitơ (N) trong HNO3 và 1 nitơ (N) trong C6H5NO2, vậy ta không cần điều chỉnh số lượng nitơ.
C6H6 + HNO3 → C6H5NO2 + H2O
Bước 5: Cân bằng nguyên tử oxi (O).
Ta có 3 oxi (O) trong HNO3 và 2 oxi (O) trong C6H5NO2, vậy ta cần thêm 1 oxi (O) vào phía trái của phương trình:
C6H6 + HNO3 → C6H5NO2 + H2O
Bước 6: Kiểm tra lại phương trình đã cân bằng.
C6H6 + HNO3 → C6H5NO2 + H2O
Các mẹo để cân bằng phương trình hóa học chuẩn nhất:
Để cân bằng phương trình hóa học, bạn cần điều chỉnh hệ số phía trước các chất tham gia và sản phẩm sao cho số nguyên tử của các nguyên tố và số lượng các phân tử là cân bằng trên cả hai phía của phương trình.
Phương trình hóa học ban đầu là: C6H6 + HNO3 → C6H5NO2 + H2O
Để cân bằng phương trình này, bạn có thể làm theo các bước sau:
Bước 1: Cân bằng số nguyên tử của các nguyên tố không liên kết. Trong phương trình này, chúng ta có 6 nguyên tử C và 6 nguyên tử H trên cả hai phía. Vì vậy, chúng ta không cần điều chỉnh số lượng nguyên tử C và H.
Bước 2: Cân bằng số nguyên tử của các nguyên tố liên kết. Hiện tại, chúng ta có 1 nguyên tử N và 3 nguyên tử O trên phía phải, nhưng không có nguyên tử N và O nào trên phía trái. Vì vậy, chúng ta cần thêm các hệ số phía trước HNO3, C6H5NO2 và H2O để cân bằng số nguyên tử của N và O.
Bước 3: Cân bằng số lượng các phân tử. Ở bước này, bạn điều chỉnh hệ số phía trước các chất tham gia và sản phẩm để cân bằng số lượng các phân tử.
Phương trình đã cân bằng: C6H6 + 3HNO3 → C6H5NO2 + 3H2O
Vậy phương trình hóa học đã được cân bằng là: C6H6 + 3HNO3 → C6H5NO2 + 3H2O
Cách giải phương trình:
Phương trình hóa học bạn đã đưa ra là một phản ứng ester hóa, trong đó benzen (C6H6) phản ứng với axit nitric (HNO3) để tạo ra nitrobenzen (C6H5NO2) và nước (H2O). Dưới đây là quá trình giải phương trình:
C6H6 + HNO3 → C6H5NO2 + H2O
Đầu tiên, chúng ta xem xét nguyên tố mỗi phía phương trình để đảm bảo số lượng nguyên tố và số lượng nguyên tử của mỗi nguyên tố trên cả hai phía bằng nhau.
Trên phía trái của phản ứng:
- Carbon (C): 6 nguyên tử
- Hydro (H): 6 nguyên tử
- Nitơ (N): 1 nguyên tử
- Oxi (O): 3 nguyên tử
Trên phía phải của phản ứng:
- Carbon (C): 6 nguyên tử
- Hydro (H): 6 nguyên tử
- Nitơ (N): 1 nguyên tử
- Oxi (O): 3 nguyên tử
Cả hai phía phản ứng đều có cùng số lượng nguyên tử của mỗi nguyên tố, do đó, phương trình đã được cân bằng.
Để hoàn thành quá trình giải phương trình, bạn cần ghi rõ các điều kiện và điều chỉnh hệ số phản ứng (nếu cần).
Một số kiến thức về Benzen
Tính chất vật lý Benzen
Bezen là chất lỏng, không màu, có mùi thơm đặc trưng nhẹ hơn nước và không tan trong nước.
Tính chất hóa học Benzen
Tính chất hóa học nổi bật của benzen là phản ứng thế, phản ứng cộng và phản ứng oxi hóa. Và đây cũng là 3 tính chất hóa học phổ biến của các chất thuộc đồng đẳng benzen hoặc các hiđrocacbon thơm.
Phản ứng thế
C6H6+ Br2 → C6H5Br + HBr (Fe, to)
C6H6 + HNO3 → C6H5NO2 + H2O (H2SO4 đặc, to)
Phản ứng cộng
C6H6 + 3H2 → xiclohexan (Ni, to)
C6H6 + 3Cl2 → C6H6Cl6 (as) (hexacloran hay 666 hay 1,2,3,4,5,6 – hexacloxiclohexan)
Phản ứng oxi hóa
Benzen không làm mất màu dung dịch KMnO4.
Oxi hóa hoàn toàn:
C6H6 + 7,5O2 → 6CO2+ 3H2O (to)
Điều chế benzen
Từ axetilen:
3C2H2 → C6H6 (C, 600oC)
Tách H2 từ xiclohexan:
C6H12→ C6H6 + 3H2 (to, xt)
BÀI TẬP VẬN DỤNG CAO:
Câu 1: Benzen có tính chất:
A. Dễ tham gia phản ứng thế, khó tham gia phản ứng cộng và bền với các chất oxi hóa
B. Khó tham gia phản ứng thế, dễ tham gia phản ứng cộng
C. Khó thế, khó cộng và bền với các chất oxi hóa
D. Dễ thế, dễ cộng và bền với các chất oxi hóa
Xem đáp án
Đáp án A
Benzen có tính chất: Dễ tham gia phản ứng thế, khó tham gia phản ứng cộng và bền với các chất oxi hóa
Câu 2: Dãy đồng đẳng của benzen có công thức chung là:
A. CnH2n+2
B. CnH2n−2
C. CnH2n−4
D. CnH2n−6
Đáp án C
Câu 3: Benzen tác dụng với Cl2 có ánh sáng, thu được hexancloran. Công thức của hexancloran là
A. C6H6Cl2
B. C6H6Cl6
C. C6H5Cl
D. C6Cl6
Đáp án B: C6H6 + 3Cl2 → C6H6Cl6
Câu 4: Chất nào sau đây có khả năng tham gia trùng hợp tạo polime?
A. benzen
B. toluen
C. propan
D. striren
Đáp án B
Câu 5: Toluen có phản ứng thế ở nhân thơm tương tự benzen nhưng khác với benzen ở chỗ:
A. Phản ứng của toluen xảy ra chậm hơn và chỉ có một sản phẩm duy nhất
B. Phản ứng của toluen xảy ra chậm hơn và thường có hai sản phẩm
C. Phản ứng của toluen xảy ra dễ dàng hơn và thường có hai sản phẩm thế vào vị trí ortho và para
D. Phản ứng của toluen xảy ra nhanh hơn và chỉ có một sản phẩm duy nhất
Đáp án C
Toluen có phản ứng thế ở nhân thơm tương tự benzen nhưng khác với benzen ở chỗ:
C. Phản ứng của toluen xảy ra dễ dàng hơn và thường có hai sản phẩm thế vào vị trí ortho và para
Câu 6. Hóa chất để phân biệt: benzen, axetilen, striren là:
A. Dung dịch Br2
B. Dung dịch Br2, Dung dịch AgNO3/NH3
C. Dung dịch AgNO3
D. Cu(OH)2, dung dịch AgNO3/NH3
Đáp án B
Trích mẫu thử và đánh số thứ tự
Khi cho KMnO4 ở điều kiện thường vào lần lượt các ống nghiệm
Ống đựng axetilen và stiren làm nhạt màu KMnO4.
Ống đựng benzen không hiện tượng.
Cho tiếp 2 dung dịch axetilen và stiren vào dung dịch AgNO3/ NH3, đun nóng
Ống đựng axetilen có lớp Ag màu trắng xám
Ống đựng stiren không hiện tượng.
Câu 7. Nhận xét nào dưới đây không đúng?
A. Benzen và toluen đều không có phản ứng với dung dịch nước brom.
B. Benzen và toluen đều có phản ứng thế với brom khi có xúc tác Fe.
C. Benzen và toluen đều có thể tham gia phản ứng cộng.
D. Toluen tham gia phản ứng thế nguyên tử H của vòng benzen khó hơn benzen.
Đáp án D
Câu 8. Hiện tượng gì xảy ra khi cho brom lỏng vào ống nghiệm chứa benzen, lắc rồi để yên?
A. Có khí thoát ra
B. Dung dịch tách thành 2 lớp
C. Xuất hiện kết tủa
D. Dung dịch đồng nhất.
Đáp án D
Câu 9. Hóa chất để phân biệt benzen, axetilen và stiren là
A. Cu(OH)2, dung dịch AgNO3/NH3
B. dung dịch brom, dung dịch AgNO3/NH3
C. dung dịch brom
D. dung dịch AgNO3/NH3
Đáp án B

