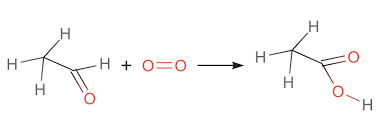
CH3CHO + O2 → CH3COOH Đây là tài liệu rất hữu ích giúp bạn đọc tiết kiệm thời gian và công sức. Dưới đây là các chi tiết để bạn tham khảo.
1. Phương trình phản ứng CH3CHO + O2:
CH3CHO + O2 CH3COOH
2. Điều kiện để phản ứng xảy ra:
Nhiệt độ, xúc tác: Mn . ion2+
3. Phản ứng giữa CH3CHO + O2:
Phản ứng giữa CH3CHO (axetanđehit) với O2 (oxi) là phản ứng cháy hay phản ứng oxi hóa. Ở điều kiện thích hợp, phản ứng này có thể xảy ra theo phương trình hóa học sau:
2 CH3CHO + 3 O2 → 2 CO2 + 2 H2O
Trong phản ứng này, hai phân tử acetaldehyde (CH3CHO) phản ứng với ba phân tử oxy (O2) để tạo ra hai phân tử CO2 (cacbon điôxit) và hai phân tử H2O (nước).
Đây là phản ứng đốt cháy hoàn toàn trong điều kiện đủ oxi. Trong quá trình đốt cháy, acetaldehyde oxy hóa thành carbon dioxide và nước, giải phóng năng lượng dưới dạng nhiệt và ánh sáng.
Nếu muốn biết thêm về các thông số cụ thể của phản ứng này, chẳng hạn như nhiệt độ, áp suất hoặc tốc độ phản ứng, thì cần xem xét thêm các điều kiện cụ thể của hệ thống và nghiên cứu chi tiết hơn về phản ứng. này trong điều kiện đó.
4. Phương trình CH3CHO + O2 rút gọn:
Có thể viết phương trình rút gọn của quá trình oxi hóa axit axetic (CH3CHO) bằng oxi (O2) trong môi trường axit như sau:
2CH3CHO + O2 → 2CH3COOH
Trong phản ứng này, hai phân tử axit axetic (CH3CHO) phản ứng với một phân tử oxy (O2) để tạo thành hai phân tử axit axetic (CH3COOH).
CHỈ MỘT3COOH là gì? Đó là công thức hóa học của axit axetic, một loại axit được sử dụng rộng rãi trong đời sống hàng ngày, đặc biệt là trong lĩnh vực ẩm thực, nấu nướng với tên gọi “dấm ăn”. CHỈ MỘT3COOH là công thức hóa học của axit axetic, một hợp chất hữu cơ có tính axit mạnh. Là một loại hóa chất đã được sản xuất từ rất lâu và có nhiều ứng dụng trong thực tế như sản xuất công nghiệp, chế biến thực phẩm, y học,….
Một số tên gọi khác của CH3COOH: Axit axetic, axit ethanoic, Hydro axetat (HAc), Axit etylic, Axit metancacboxylic, giấm ăn, Axit etanoic,… Cấu tạo phân tử của axit axetic gồm một nhóm metyl (-CH).3) liên kết với nhóm cacboxyl (-COOH).
đầu tiên, tính chất vật lý:
– Là chất lỏng không màu, có vị chua;
Độ tan: Tan vô hạn trong nước, tan tốt trong cellulose và nitrocellulose. Ngoài ra, khi đun nóng, axit axetic có thể hòa tan một lượng nhỏ photpho và lưu huỳnh;
– Dễ cháy và ở nhiệt độ ấm (>39°C), axit axetic được coi là hợp chất hữu cơ dễ bay hơi gây ô nhiễm.
– Khối lượng riêng: 1.049 g/cm3 (l), 1.266 g/cm3 (s).
– Điểm nóng chảy: 16,7°C
– Điểm sôi: 118,2°C
– Áp suất hơi nước: 1,5 kPa @ 20°C.
– Nhiệt độ sôi của CH3COOH lớn hơn ancol dù chúng có cùng phân tử khối. Lý do là liên kết bền vững của các phân tử hydro trong axit axetic lớn hơn trong rượu.
Thứ hai, Tính chất hóa học: Phản ứng với bazơ tạo thành muối etanoat kim loại và nước (CHỈ3COOH + NaOH → H2O + CHỈ3COONa).
CH3CHO + O2 → CH3COOH
– Phản ứng với oxit bazơ tạo thành muối và nước: CHỈ3COOH + CaO → H2O + (CHỈ3giám đốc điều hành)2Sự thay đổi
– Phản ứng với kim loại đứng trước H trong bảng tuần hoàn các nguyên tố hóa học và sinh ra khí hiđro: 2CH3COOH + Na → H2 + 2 DUY NHẤT3COONa
Nhôm thụ động với axit axetic vì khi phản ứng xảy ra sẽ tạo ra một màng nhôm oxit mỏng trên bề mặt ngăn cản sự ăn mòn.
– Phản ứng với muối của axit yếu hơn: CHỈ3COOH + CaCO3 → BẠN BÈ2O + (CHỈ3giám đốc điều hành)2Ca + CO2
– Phản ứng với ancol ở điều kiện nhiệt độ, có xúc tác axit sunfuric tạo este và nước: CHỈ3COOH + H O – C2h5 → BẠN BÈ2O + CHỈ3COOC2h5 + BẠN BÈ2Ô
– Tham gia phản ứng thế halogen thành gốc hiđrocacbonat (90-100 .)oC): Cl2 + CHỈ3COOH → ClCH2COOH + HCl
– Phản ứng với axetilen trong điều kiện có xúc tác thủy ngân và đun nóng ở 70 – 80 oC để tạo thành etyl diaxetat: C2h2 + 2 DUY NHẤT3COOH → CHỈ3CH(OCOCH)3)2
– Phản ứng với amoniac và tạo thành amit: NHỎ3 + CHỈ3COOH → NHỎ3CHỈ MỘT3COOHNH4
– Phản ứng decacboxyl hóa thành axeton khi có xúc tác mangan oxit và đun nóng: C2h2+ CHỈ3COOH → CHỈ2SÔCÔ3
5. Bài tập liên quan:
Phương trình hóa học bạn cung cấp không đầy đủ. Để cân bằng nó, chúng ta cần biết sản phẩm phụ thuộc vào điều kiện phản ứng. Sau đây là cách cân bằng phương trình tổng quát của quá trình oxi hóa rượu etylic (ethanol).
Phương trình tổng quát của quá trình oxi hóa ancol etylic là:
C2H5OH + O2 → CO2 + H2O
Để cân bằng phương trình này, bạn cần làm theo các bước sau:
Bước 1: Cân bằng số lượng nguyên tử cacbon (C) bằng cách thêm các hệ số vào trước các chất phản ứng:
C2H5OH + O2 → 2CO2 + H2O
Bước 2: Cân bằng số nguyên tử hydro (H) bằng cách thêm các hệ số ở phía trước các chất phản ứng:
C2H5OH + O2 → 2CO2 + 3H2O
Bước 3: Cân bằng số nguyên tử oxi (O) bằng cách thêm hệ số vào trước O2:
C2H5OH + 3O2 → 2CO2 + 3H2O
Bây giờ, phương trình được cân bằng. Nguyên liệu đầu vào là rượu etylic (C2H5OH) và oxi (O2), sản phẩm là khí cacbonic (CO2) và nước (H2O).
Câu 1: Có bao nhiêu anđehit hai chức có công thức đơn giản nhất là C.?2h3Ô?
A. 2
B 4
C.1
mất 3
Đáp án A. Anđehit có dạng C2nh3nÔN (anđehit no, mạch hở, chức)
Vì anđehit no, mạch hở, đơn chức nên bậc không no: k = n
Ta có: H = 2C + 2 – 2k => 3n = 2.2n + 2 – 2n => n = 2
Vậy công thức cấu tạo của anđehit là C4h6Ô2
=> Có 2 đồng phân: HOC-CH2– CHỈ MỘT2-ĐƯA CHO; CHỈ MỘT3CH(CHO)2
Câu 2: Có thể dùng chất nào sau đây để nhận biết các chất: ancol etylic, glixerol, dung dịch anđehit axetic đựng trong ba lọ không dán nhãn?
A. Cu(OH)2/Ồ–
B. Quỳ tím
C. Kim loại Na
D. dd AgNO3/BÉ NHỎ3.
Đáp án A. Trích mẫu và đánh số thứ tự
Dùng thuốc thử Cu(OH)2/OH− để nhận biết các chất không có nhãn
| CŨ3h5(Ồ)3 | CHỈ MỘT3ĐƯA CHO | CŨ2h5Ồ | |
| Cu(OH)2/OH- (thường to) | phức hợp màu xanh | Không phản hồi | Không phản hồi |
| Cu(OH)2/OH- nóng lên | Kết tủa đỏ gạch | Không phản hồi |
phương trình hóa học
Cu(OH)2 + 2C3h5(Ồ)3 → [C3H5(OH)2O]2Cu + 2H2Ô
phức hợp màu xanh
CHỈ MỘT3CHO + 2Cu(OH)2 → CHỈ3COOH + Cu2O + 2H2Ô
Câu 3: Đốt cháy hoàn toàn 0,2 mol anđehit A no, mạch hở, đơn chức thu được tổng khối lượng CO2 và họ2O là 49,6 gam. Andehit A là:
A. CŨ2h4Ô
IN ĐẬM3h6Ô2
LẠNH LẼO4hsố 8Ô
D. CŨ5hmườiÔ
Đáp án C. Đốt cháy anđehit no, đơn chức mạch hở thu được nCO2 = nH2O = một mol
=> mCO2 + mH2O = 49,6 => 44a + 18a = 49,6 => a = 0,8 mol
=> số C trong A = nCO2 / NMỘT = 0,8 / 0,2 = 4
=> Công thức phân từ của A là C4hsố 8Ô
Câu 4: Hợp chất A chứa C, H, O có M < 90 đvC. A tham gia tráng bạc và có thể phản ứng với H .2 (xt Ni) tạo ra ancol chứa C trong phân tử. Công thức của A là:
A. (CHỈ3)2CHCHO.
B. (CHỈ3)2CH-CHỈ2ĐƯA CHO.
C. (CHỈ3)3C-CHỈ2ĐƯA CHO.
D. (CHỈ3)3CCHO.
Đáp án D. Hợp chất A có khả năng tráng bạc nên A chứa gốc –CHO
Rượu chứa C bậc IV => có dạng (CHỈ3)3CR-CHO
Bởi vì M < 90 => 57 + R + 29 < 90 => r = 0
CTCT của A là (CHỈ3)3CCHO.
Câu 5: Hiện nay, nguồn nguyên liệu chính để sản xuất anđehit axetic trong công nghiệp là:
A. etanol.
B. etan.
C. axetilen.
D. etilen.
Câu 6. Đốt cháy hoàn toàn 0,5 mol hợp chất hữu cơ X thu được 2 mol CO2. Chất X phản ứng với K, tham gia phản ứng tráng bạc có cộng Br.2 theo tỉ lệ mol 1 : 1. Công thức cấu tạo của X là
A. HỒ-CHỈ2– CHỈ MỘT2-CH=CH-CHO.
B. HOOC-CH=CH-COOH.
C. HỒ-CHỈ2-CH=CH-CHO.
D. HO-CHỈ2– CHỈ MỘT2– CHỈ MỘT2-ĐƯA CHO
Đáp án C. X: có 4C, chứa nhóm OH hoặc COOH, nhóm -CHO và có 1 liên kết đôi C=C
Lưu ý RCHO + Br . sự phản ứng lại2 + BẠN BÈ2O => RCOOH + 2HBr không phải phản ứng cộng
Câu 7. Cho 6,8 gam một chất hữu cơ A (có thành phần nguyên tố C, H, O) tác dụng vừa đủ với dung dịch chứa 0,3 mol AgNO3 trong NH3, đun nóng thu được 21,6 gam Ag. Công thức cấu tạo của A là:
A. CHẮC CHẮN-[CH2]2-ĐƯA CHO.
B. CHỈ2=C=CH-CHO.
C. BẢO ĐẢM – CÔNG BẰNG2ĐƯA CHO .
D. CHỈ3– CẮT CHO.
Đáp án C. Ta có:
NAg = 21,6 /108 = 0,2 mol → nX = 0,1 mol (Cả 4 đáp án đều là anđehit đơn chức)
NAg = 0,2 mol < nphản ứng với AgNO3 = 0,3 mol.
Vậy X có 3 đầu mạch
Hoa KỳX = 68 = R + 29 → R= 39 (C3H3-)