Áp suất là một đại lượng vật lí gắn liền với đời sống con người từ xưa đến nay. Đặc biệt, đây cũng là một trong những kiến thức quan trọng đối với các bạn học sinh lớp 8, lớp 9. lớp 10. Vậy bạn đã biết cụ thể về áp suất chưa? Công thức tính áp suất và ứng dụng của nó ra sao?
Sau đây, đội ngũ INVERT chúng tôi sẽ hướng dẫn bạn biết công thức tính áp suất đơn giản, chi tiết, thông qua bài viết sau.
Mục lục bài viết [Ẩn]

I. Áp suất là gì? Đơn vị tính áp suất?
Áp suất trong vật lý học có tên tiếng anh là Pressure, và thường được viết tắt bởi chữ cái đầu ” P “. Là một đại lượng vật lý hay lực trên 1 đơn vị diện tích tác dụng theo chiều vuông góc với bề mặt của vật thể
Trong hệ đo lường quốc tế (SI), đơn vị của áp suất được tính bằng Newton trên mét vuông (N/m2), và được gọi là Pascal (Pa) .
1 Pa rất nhỏ, nó xấp xỉ bằng với 1 đồng đô la tác dụng lên mặt bàn vậy và 1kPa = 1000 Pa.
Theo thống kê, đơn vị đo áp suất ở những khu vực khác nhau sẽ khác nhau. Sau đây là một số đơn vị phổ biến được sử dụng:
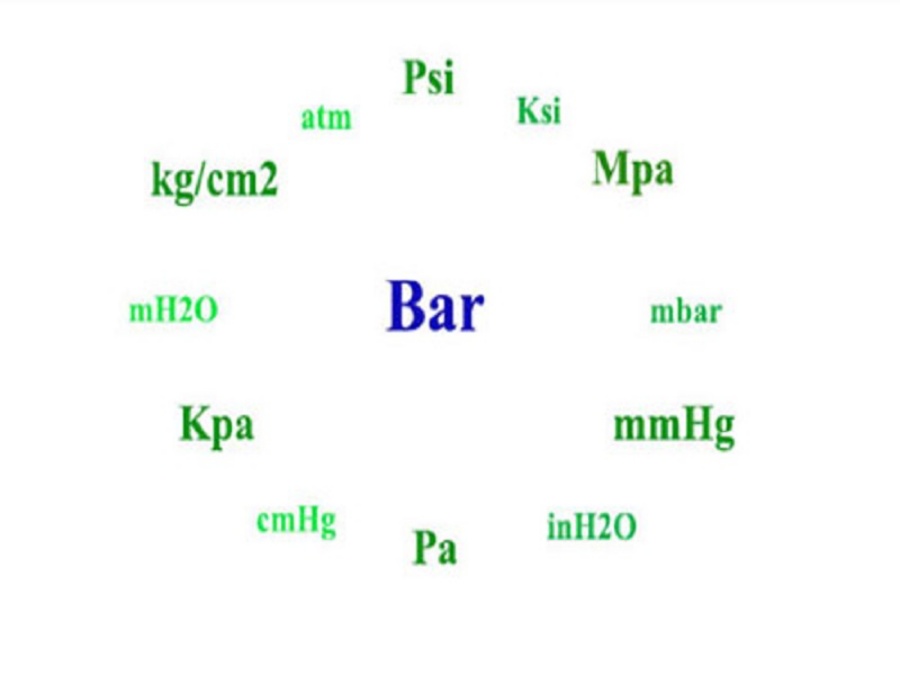
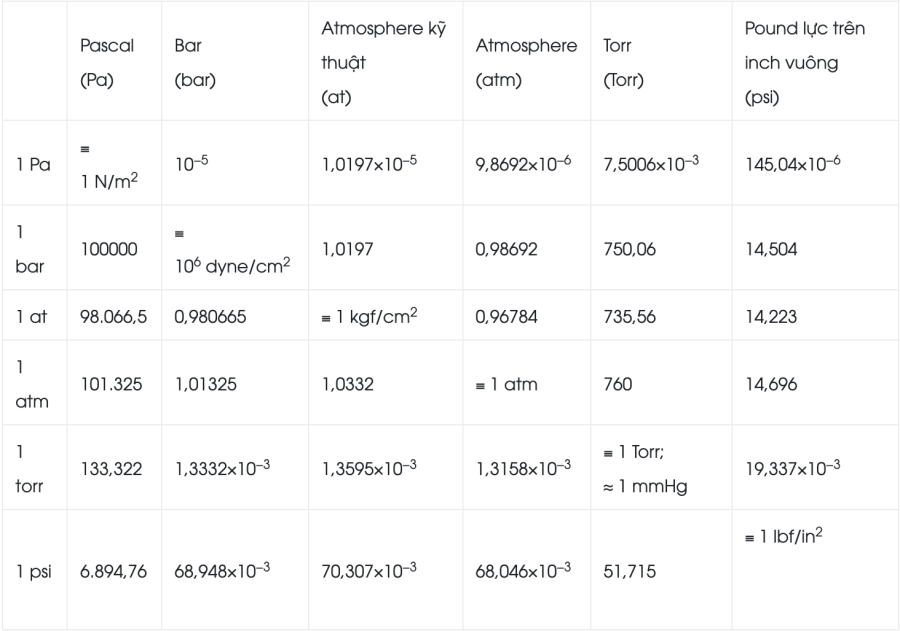
Bảng quy đổi giữa các đơn vị đo áp suất:
II. Công thức tính áp suất thường gặp
Tùy thuộc vào môi trường rắn, lỏng khí… sẽ cho ra những công thức tính áp suất khác nhau. Cụ thể:
1. Công thức tính áp suất chất rắn
Áp suất chất rắn là áp lực tác dụng lên 1 đơn vị diện tích xác định và được ứng dụng trong lĩnh vực y tế, xây dựng, thực phẩm…
Công thức:
P = F / S
Trong đó:
- P: áp suất của chất rắn, đơn vị là N/m2, Pa, Bar, mmHg, Psi.
- F: là áp lực vuông góc tác động lên bề mặt diện tích đơn vị N.
- S: là diện tích bề mặt bị F tác động( đơn vị m2).

2. Công thức tính áp suất chất lỏng, khí
Áp suất chất lỏng và khí sẽ có công thức tính giống nhau vì đều là lực đẩy của lưu chất bên trong hệ thống đường ống. Khi lực đẩy càng nhanh thì áp suất càng mạnh và ngược lại lực đầy càng yếu, áp suất càng yếu.
Công thức:
P = D.H
Trong đó:
- P: áp suất chất lỏng hoặc khí cần tính (Đơn vị Pa hoặc bar)
- D: trọng lượng riêng của chất lỏng hoặc khí (đơn vị N/m2).
- H: chiều cao của chất lỏng chất hoặc khí (mét)
3. Công thức tính áp suất thủy tĩnh
Áp suất tĩnh (Hydrotatic Pressure) là áp lực được tính khi mực chất lỏng ở mức cân bằng không có dao động.
Công thức:
P = Po + pgh
Trong đó:
- P: khối lượng riêng mặc định của một đơn vị chất lỏng, đơn vị kg/m3
- Po: áp suất khí quyển
- g: gia tốc trọng trường
- h: chiều cao từ đáy lên mặt tĩnh của chất lỏng.
4. Công thức tính áp suất thẩm thấu
Áp suất thẩm thấu được hiểu là lực đẩy trong hiện tượng thẩm thấu (sự dịch chuyển của dung môi từ dung dịch có nồng độ thấp sang nồng độ cao). Áp suất này tỷ lệ thuận với nồng độ cũng như nhiệt độ của dung dịch.
Công thức:
P = R*T*C
Trong đó:
P: áp suất thẩm thấu, đơn vị atm.
R: là hằng số cố định 0,082
T: nhiệt độ tuyệt đối, T = 273 + t oC
C: lượng nồng độ dung dịch được phân li theo tỷ lệ từng dung chất, đơn vị gam/lit.
5. Công thức tính áp suất riêng phần
Áp suất riêng phần của 1 chất khí khi nằm trong 1 hỗn hợp khí nếu giả thiết 1 mình khí đó chiếm toàn bộ thể tích của hộp.
Công thức:
pi = xi.p
Trong đó:
- pi: áp suất riêng phần
- xi: phần mol xi của phần tử i trong hỗn hợp khí
- p: áp suất toàn phần
6. Công thức tính áp suất tuyệt đối
Áp suất tuyệt đối được tính bằng tổng của áp suất tương đối và áp suất khí quyển vì là áp suất được gây ra bởi cả khí quyển và cột chất lỏng tác dụng lên điểm trong lòng chất lỏng.
Công thức:
P = pa+pd
Trong đó:
- P: áp suất tuyệt đối
- pa: áp suất tương đối
- pd: áp suất khí quyển
7. Công thức tính áp suất dư
Áp suất dư còn được gọi là áp suất tương đối là áp suất tại 1 thời điểm mà chất lỏng và chất khí lấy mốc là áp suất khí quyển lân cận xung quanh.
Công thức:
Pd = P – Pa
Trong đó:
- Pd: áp suất tương đối
- P: áp suất tuyệt đối
- Pa: áp suất khí quyển
Lưu ý: Nếu chất lỏng đứng yên sẽ có công thức tính áp suất dư như sau:
Pdu = y.h
Trong đó: y là khối lượng riêng của chất lỏng, h là chiều sâu của điểm đang xét tính từ mặt thoáng của chất lỏng.
8. Công thức tính áp suất nước trong đường ống
Đối với ống nước hình tròn:
+ Tính tiết diện ngang ống = bình phương bán kính x 3,14 (số pi); đơn vị m2.
+ Tính vận tốc nước chảy trong ống = căn bậc 2 của 2gh; trong đó g=9,81; h: chiều cao cột nước, đơn vị m.
+ Lưu lượng nước chảy qua ống = tiết diện ngang ống x vận tốc nước qua ống.
+ Công thức lưu lượng nước chảy trong ống được tính như sau: qtt = qvc + α . qdđ (l/s)
Các công thức trên thực hiện tính toán được sơ bộ cơ sở áp lực lưu lượng nước trong ống đựa theo thủy lực, độ co hép ngang và hệ số lưu lượng,..Dựa vào kết quả thu được có thể lắp công trình máy thủy điện hay hệ thống tưới tiêu thủy lợi tự động.
Trong đó:
- α: hệ số phân bố lưu lượng dọc đường, thông thường lấy là α = 0.5 (q ở đoạn đầu ống max và cuối ống là 0).
- qdđ: lưu lượng dọc đường của đoạn ống đang xét (đơn vị tính l/s).
9. Công thức tính áp suất hơi
Trong hóa học, áp suất hơi là áp suất tác động lên vách bình kín khi chất lỏng trong bình bốc hơi (chuyển thành thể khí). Điển hình việc bạn để 1 chai nước ngoài trời nắng trong vài tiếng, sau đó mở nắp chai và nghe thấy một tiếng “phụt” nhỏ. Âm thanh này chính là do áp suất hơi trong chai gây ra.
Công thức:
ln(P1/P2) = (ΔHvap/R)((1/T2) – (1/T1))
Trong đó:
- ΔHvap: Entanpy bay hơi của chất lỏng. Giá trị này có thể tra trong bảng ở cuối sách giáo khoa hóa học.
- R: Hằng số khí lý tưởng và bằng 8,314 J/(K × Mol).
- T1: Nhiệt độ tại đó áp suất hơi đã biết (nhiệt độ ban đầu).
- T2: Nhiệt độ tại đó áp suất hơi cần phải tính (nhiệt độ cuối cùng).
- P1 và P2: Áp suất hơi tương ứng tại nhiệt độ T1 và T2.
III. Hướng dẫn các cách tính áp suất
1. Cách tính áp suất hơi
Để tính áp suất hơi một cách dễ dàng, bạn có thể sử dụng các công thức sau:
Sử dụng phương trình Clausius-Clapeyron
Bước 1: Viết phương trình Clausius-Clapeyron
Công thức tính áp suất hơi Clausius-Clapeyron (đặt tên theo tên 2 nhà vật lý Rudolf Clausius và Benoît Paul Émile Clapeyron). Công thức như sau: ln(P1/P2) = (ΔHvap/R)((1/T2) – (1/T1)).
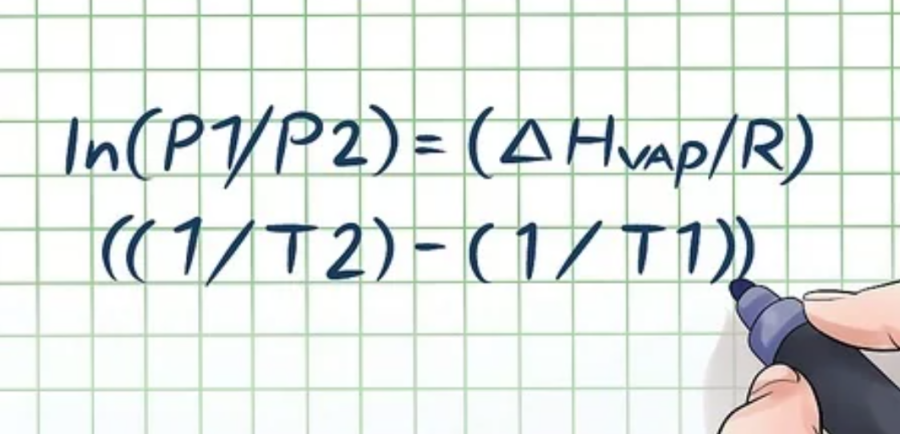
Bước 2: Thay các giá trị đã biết vào biến số
Tiếp theo, bạn thay các giá trị nhiệt độ và 1 hoặc 2 giá trị áp suất 1 giá trị nhiệt độ. Lưu ý, bạn phải sử dụng giá trị nhiệt độ là Kelvin
Ví dụ: Một bình chứa chất lỏng ở nhiệt độ 295 K và có áp suất hơi là 1 atmosphere (atm). Khi đó, áp suất hơi ở nhiệt độ 393 K là bao nhiêu?
Giải: Thay giá trị vào các biến số, chúng ta có ln(1/P2) = (ΔHvap/R)((1/393) – (1/295))
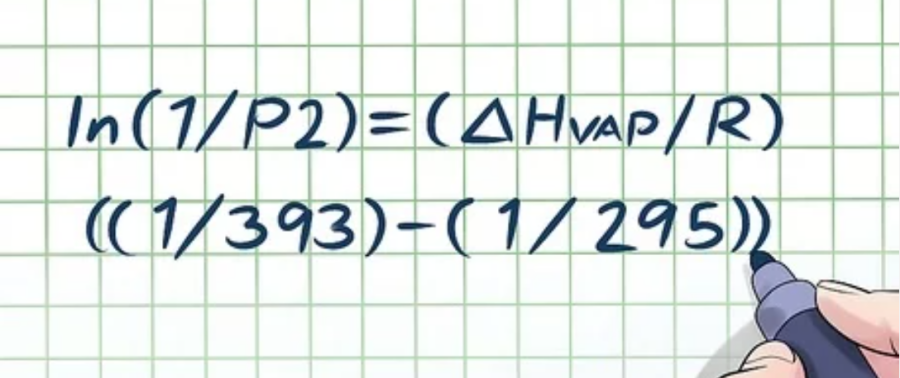
Bước 3: Thay các hằng số vào
Phương trình Clausius-Clapeyron có 2 hằng số: R và ΔHvap.
Trong đó:
- R luôn luôn bằng 8,314 J/(K × Mol).
- ΔHvap (entanpy bay hơi) phụ thuộc vào loại chất lỏng sinh hơi mà bài toán cho (bạn có thể tra các giá trị ΔHvap của nhiều loại chất khác nhau ở cuối SGK hóa học hay vật lý hay tra trực tuyến).
Xét theo ví dụ trên: Giả sử chất lỏng là nước tinh khiết. Trong bảng giá trị ΔHvap, ta có ΔHvap của nước tinh khiết xấp xỉ là 40,65 kJ/mol. Vì giá trị H sử dụng đơn vị joul nên bạn phải đổi nó thành 40.650 J/mol ⇒ ln(1/P2) = (40.650/8,314)((1/393) – (1/295)).
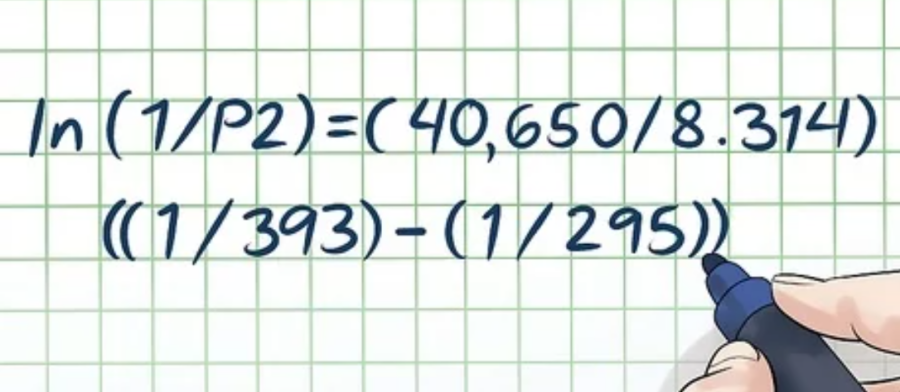
Bước 4: Giải phương trình
Sau khi bạn đã thay tất cả các giá trị vào biến số của phương trình, bạn làm như sau:
Xét theo ví dụ trên: (ln(1/P2) = (40.650/8,314)((1/393) – (1/295)). Để triệt tiêu hàm log tự nhiên và sử dụng cả 2 vế của phương trình làm số mũ cho hằng số toán học e hay, ln(x) = 2 → eln(x) = e2 → x = e2. Khi đó:
- ln(1/P2) = (40.650/8,314)((1/393) – (1/295))
- ln(1/P2) = (4.889,34)(-0,00084)
- (1/P2) = e(-4,107)
- 1/P2 = 0,0165
- P2 = 0,0165-1 = 60,76 atm.
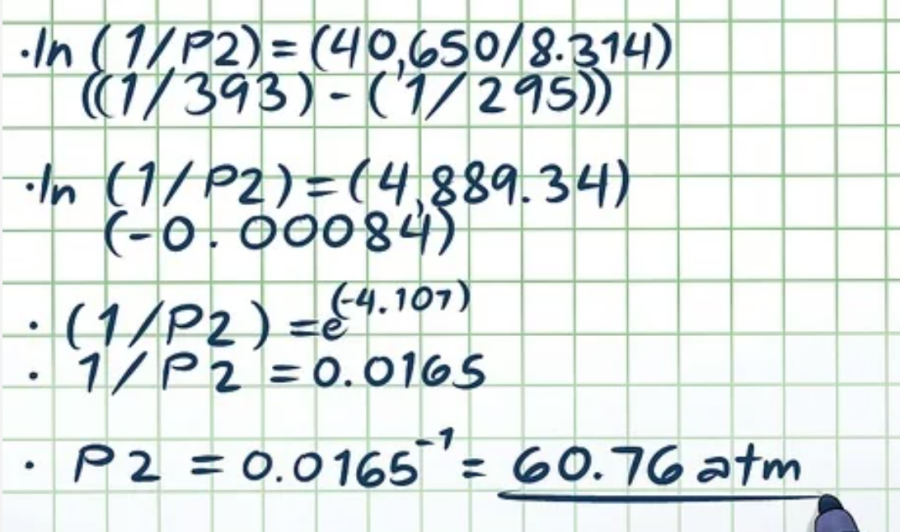
Tìm áp suất hơi của dung dịch hòa tan
Bước 1: Viết Định luật Raoult
Trước hết, bạn cần viết ra phương trình của Định luật Raoult (đặt tên theo nhà vật lý François-Marie Raoult), có dạng như sau: Pdung dịch=Pdung môiXdung môi.
Trong đó:
- Pdung dịch: Áp suất hơi của toàn bộ dung dịch (tất cả các thành phần cấu thành dung dịch)
- Pdung môi: Áp suất hơi của dung môi
- Xdung môi: Phần mol của dung môi.
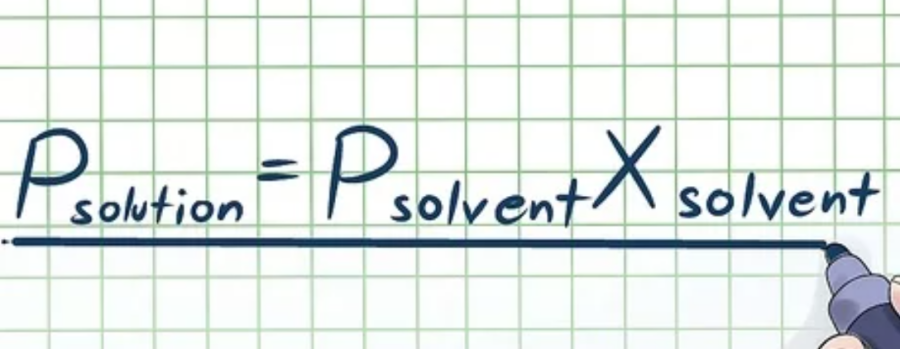
Bước 2: Phân biệt dung môi và chất tan trong dung dịch
Sau đó, bạn cần nhận biết các chất được bài toán cho. Nên nhớ dung dịch được hình thành khi chất tan hòa tan trong dung môi và hóa chất bị hòa tan luôn luôn là chất tan, và hóa chất làm nhiệm vụ hòa tan là dung môi.
Ví dụ: Tìm áp suất hơi của dung dịch sirô. Vì sirô được pha chế từ một phần đường hòa tan trong một phần nước, do vậy bạn có thể nói đường là chất tan và nước là dung môi.
Lưu ý: công thức hóa học của saccarôzơ (đường cát) là C12H22O11.

Bước 3: Tìm nhiệt độ của dung dịch
Theo giả thiết, nhiệt độ của chất lỏng sẽ ảnh hưởng đến áp suất hơi của nó. Hay nhiệt độ càng cao thì áp suất hơi càng cao và khi nhiệt độ tăng, chất lỏng bay hơi nhiều hơn và làm tăng áp suất trong bình.
Xét theo ví dụ trên: Giả sử nhiệt độ hiện tại của sirô là 298 K (khoảng 25 C).

Bước 4: Tìm áp suất hơi của dung môi
Bạn có thể tra các giá trị tra từ tài liệu hay Google để cho ra kết quả áp suất và nhiệt độ 298 K (25 C) cho P1 và T1.
Xét theo ví dụ trên: Hỗn hợp có nhiệt độ 25 °C nên có áp suất hơi là 23,8 mmHg
Bước 5: Tìm phần mol của dung môi
Tới đây, bạn đổi các thành phần sang mol, rồi tìm giá trị % của mỗi thành phần trong tổng số mol của hỗn hợp. Hay phần mol của mỗi thành phần bằng (số mol của thành phần)/(tổng số mol của hỗn hợp).
Giả sử: Công thức pha chế của sirô là 1 lít (L) nước và 1 lít saccarôzơ (đường). Khi đó, bạn cần tìm số mol của mỗi thành phần bằng cách tìm khối lượng của mỗi thành phần, rồi dùng khối lượng mol của các thành phần đó để tính ra mol.
Khối lượng (1 L nước): 1.000 gam (g)
Khối lượng (1 L đường thô): Xấp xỉ 1.056,7 g
Số mol (nước): 1.000 gram × 1 mol/18,015 g = 55,51 mol
Số mol (đường): 1.056,7 gram × 1 mol/342,2965 g = 3,08 mol (Lưu ý là bạn có thể tìm khối lượng mol của đường từ công thức hóa học của nó, C12H22O11.)
Tổng số mol: 55,51 + 3,08 = 58,59 mol
Phần mol của nước: 55,51/58,59 = 0,947
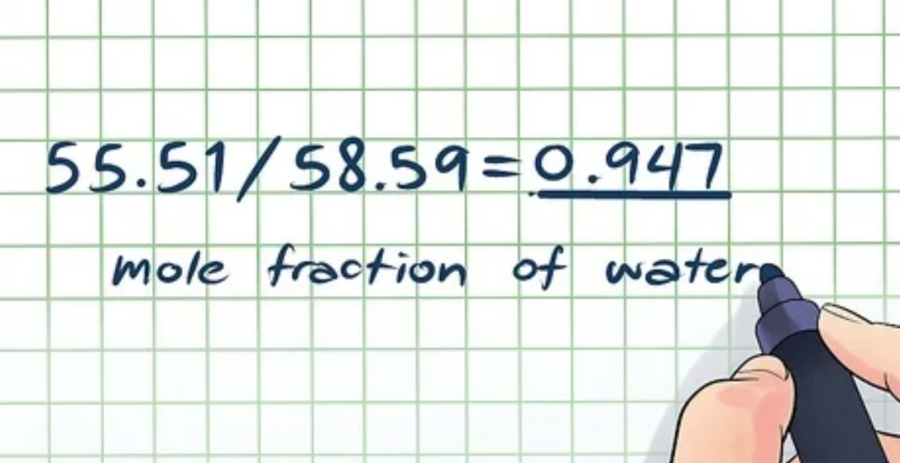
Bước 6: Giải tìm kết quả
Cuối cùng, bạn thay các giá trị vào biến số của phương trình Định lý Raoult (Pdung dịch = Pdung môiXdung môi). Ta có:
- Pdung dịch = (23,8 mmHg)(0,947)
- Pdung dịch = 22,54 mmHg.

Tìm áp suất hơi trong các trường hợp đặc biệt
Bước 1: Nhận biết điều kiện Nhiệt độ và Áp suất tiêu chuẩn
Thông thường, các nhà khoa học thường dùng 1 cặp giá trị nhiệt độ và áp suất làm điều kiện “mặc định” nên bạn cần học thuộc lòng các giá trị này để thuận tiện tính toán.
- Nhiệt độ: 273,15 K / 0 C / 32 F
- Áp suất: 760 mmHg / 1 atm / 101,325 kilopascal

Bước 2: Chuyển vế phương trình Clausius-Clapeyron để tìm các biến số khác
Đối với một số bài toán yêu cầu tìm nhiệt độ hay thậm chí là giá trị ΔHvap. Khi đó, để tìm đáp án bạn chỉ cần chuyển vế phương trình sao cho biến số cần tìm nằm ở 1 vế của phương trình, và tất cả các biến số khác nằm ở vế còn lại là được.
Ví dụ: Một chất lỏng chưa biết có áp suất hơi là 25 torr ở nhiệt độ 273 K và 150 torr ở nhiệt độ 325 K, hãy tìm entanpy bay hơi của chất lỏng này (ΔHvap).
Giải:
- ln(P1/P2) = (ΔHvap/R)((1/T2) – (1/T1))
- (ln(P1/P2))/((1/T2) – (1/T1)) = (ΔHvap/R)
- R × (ln(P1/P2))/((1/T2) – (1/T1)) = ΔHvap. Thay các giá trị vào:
- 8,314 J/(K × Mol) × (-1,79)/(-0,00059) = ΔHvap
- 8,314 J/(K × Mol) × 3.033,90 = ΔHvap = 25.223,83 J/mol
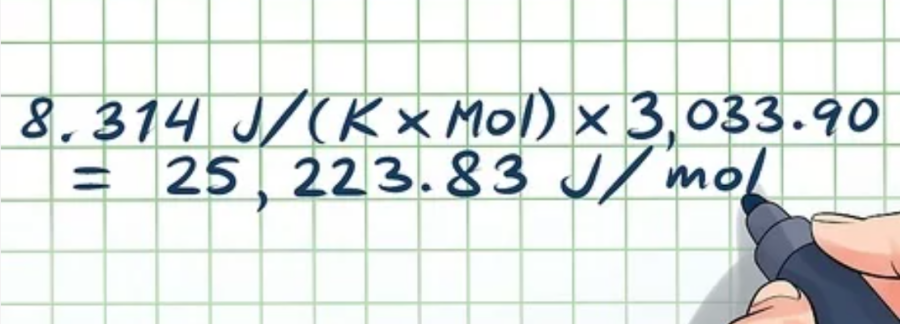
Bước 3: Tính đến áp suất hơi của chất tan khi nó bốc hơi
Theo chứng minh, khi chất tan thật sự bốc hơi thì nó sẽ ảnh hưởng đến áp suất hơi chung của dung dịch. Khi đó, bạn tính áp suất này bằng phương trình biến đổi của Định luật Raoult: Pdung dịch = Σ(Pthành phầnXthành phần), ký hiệu (Σ).
Ví dụ: Bạn có dung dịch được pha chế từ 2 hóa chất: benzen và toluen. Tổng thể tích của dung dịch là 120 mL; 60 mL benzen và 60 mL toluen. Nhiệt độ của dung dịch là 25 °C và áp suất hơi của mỗi thành phần hóa chất tại 25 C là 95,1 mmHg đối với benzen, và 28,4 mmHg đối với toluen. Hãy tìm áp suất hơi của dung dịch.
Giải:
Bạn sử dụng khối lượng riêng, khối lượng mol và áp suất hơi của 2 hóa chất đó để tính như sau:
- Khối lượng (benzen): 60 mL = 0,06 L × 876,50 kg/1.000 L = 0,053 kg = 53 g
- Khối lượng (toluen): 0,06 L × 866,90 kg/1.000 L = 0,052 kg = 52 g
- Số mol (benzen): 53 g × 1 mol/78,11 g = 0,679 mol
- Số mol (toluen): 52 g × 1 mol/92,14 g = 0,564 mol
- Tổng số mol: 0,679 + 0,564 = 1,243
- Phần mol (benzen): 0,679/1,243 = 0,546
- Phần mol (toluen): 0,564/1,243 = 0,454
- Giải tìm kết quả: Pdung dịch = PbenzenXbenzen + PtoluenXtoluen
- Pdung dịch = (95,1 mmHg)(0,546) + (28,4 mmHg)(0,454)
- Pdung dịch = 51,92 mmHg + 12,89 mmHg = 64,81 mmHg

2. Cách tính áp suất riêng phần
Để tính áp suất riêng phần, bạn chỉ cần thực hiện theo các bước sau:
Hiểu các tính chất của khí
Bước 1: Xem mỗi loại khí là khí “lý tưởng”
Trong hóa học, khí lý tưởng là khí tương tác với các khí khác mà không bị hút vào phân tử của chúng và các phân tử khí có thể va chạm với nhau rồi bật ra như bóng bi-a mà hoàn toàn không bị biến dạng.
- Áp suất của khí lý tưởng tăng khi nó bị nén vào không gian nhỏ hơn và giảm khi nó phân tán vào không gian rộng hơn. Mối quan hệ này được gọi là Định luật Boyle. Công thức là k = P x V, trong đó k là mối quan hệ không đổi giữa áp suất và thể tích, P là áp suất, V là thể tích.
- Bài toán có thể cho áp suất theo một trong nhiều đơn vị khác nhau.Điển hình là pascal (Pa) là lực 1 newton tác động lên 1 m2. Một đơn vị khác là atmosphere (atm) là áp suất của khí quyển trái đất tại độ cao bằng với mực nước biển (1 atm = 101.325 Pa).
- Nhiệt độ của khí lý tưởng tăng khi thể tích tăng và giảm khi thể tích giảm. Mối quan hệ này được gọi là Định luật Charles. Công thức là k = V / T, trong đó k là mối quan hệ không đổi giữa thể tích và nhiệt độ, V là thể tích và T là nhiệt độ.
Lưu ý: Đơn vị tính là độ Kelvin và được tính bằng cách cộng độ Celsius với 273.
Phương trình tổng quát: k = PV / T, hoặc có thể viết là PV = kT.

Bước 2: Định nghĩa đơn vị khối lượng dùng để đo lường khí
Khí có cả khối lượng và thể tích (l), nhưng có 2 dạng khối lượng của khí.
Vì hầu hết các loại khí thường rất nhẹ nên chúng còn được đo bằng khối lượng phân tử hay khối lượng mol. Ta có phương trình nR = PV/T hoặc PV = nRT.
Hoặc bạn cũng có thể viết là 0,0821 L atm K-1 mol -1 để tránh phải dùng dấu gạch chéo của phép chia trong đơn vị đo.
Bước 3: Định luật Dalton về áp suất riêng phần
Định luật Dalton phát biểu rằng áp suất toàn phần của hỗn hợp khí là tổng áp suất của từng khí trong hỗn hợp, Ptổng = P1 + P2 + P3 … với số lượng áp suất P bằng với số loại khí trong hỗn hợp.
Đối với từng áp suất riêng phần, bạn có thể viết lại phương trình khí lý tưởng PV = nRT thành dạng P = nRT/V.
Sau đó, bạn thay công thức vào phương trình áp suất riêng phần:
Ptổng =(nRT/V) 1 + (nRT/V) 2 + (nRT/V) 3 …
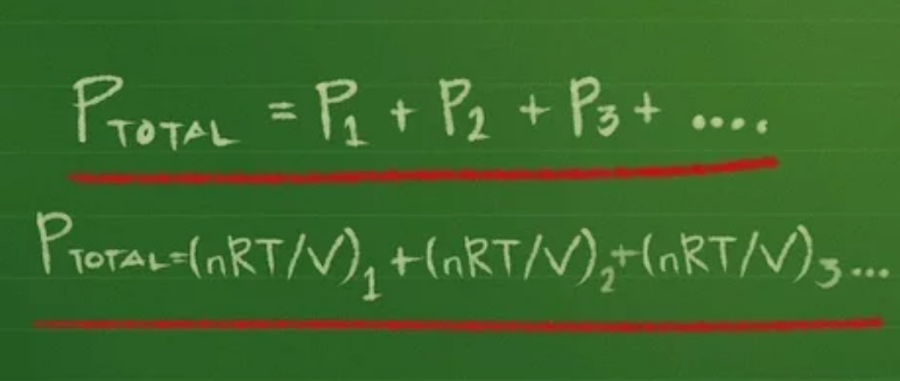
Tính áp suất riêng phần, sau đó tính áp suất toàn phần
Bước 1: Xác định phương trình áp suất riêng phần
Ví dụ: Bạn có một cái chai 2 lít chứa 3 loại khí: ni-tơ (N2), ô-xi (O2), và cacbon đi-ô-xít (CO2). Mỗi khí có 10g, và nhiệt độ của mỗi khí trong chai là 37 độ C. Tìm áp suất riêng phần của từng khí và áp suất toàn phần của hỗn hợp khí tác động lên chai.
Phương trình áp suất riêng phần: Ptổng = Pni-tơ + Pô-xi + Pcacbon đi-ô-xít.
Bạn viết lại phương trình thành: Ptổng =(nRT/V) ni-tơ + (nRT/V) ô-xi + (nRT/V) cacbon đi-ô-xít
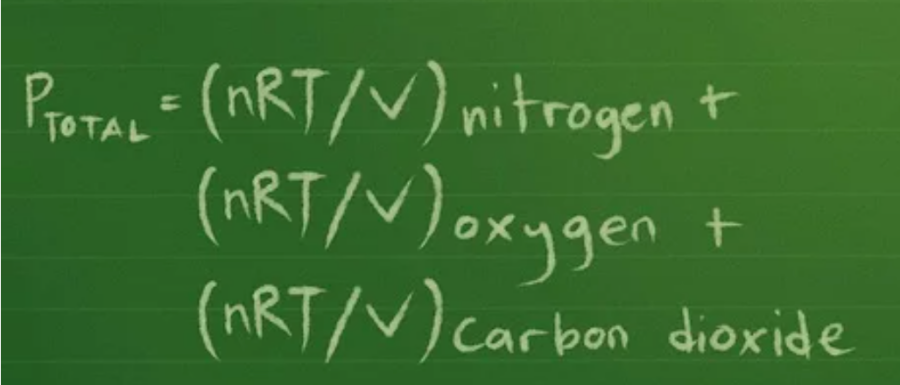
Bước 2: Đổi nhiệt độ sang độ Kelvin
Vì nhiệt độ của các khí là 37 độ C nên bạn tiến hành cộng 37 với 273 để có 310 độ K.

Bước 3: Tìm số mol của từng khí có trong chai
Số mol khí là khối lượng của khí đó chia cho khối lượng mol của nó, mà khối lượng mol là tổng khối lượng của từng nguyên tử cấu tạo nên chất đó.
- Đối với khí ni-tơ (N2), mỗi nguyên tử có khối lượng là 14. Vì phân tử ni-tơ có 2 nguyên tử, bạn phải lấy 14 x 2 = 28. Sau đó, bạn chia khối lượng theo gam là 10g cho 28 để có số mol, ≈ 0,4 mol khí ni-tơ.
- Đối với khí ô-xi (O2), mỗi nguyên tử có khối lượng là 16. Phân tử ô-xi cũng có 2 nguyên tử, bạn phải lấy 16 x 2 để có khối lượng phân tử ô-xi là 32. Chia 10g cho 32 sẽ cho kết quả xấp xỉ 0,3 mol khí ô-xi trong chai.
- Khí thứ ba là cacbon đi-ô-xít (CO2), có 3 nguyên tử: một nguyên tử cacbon có khối lượng 12, hai nguyên tử ô-xi với mỗi nguyên tử có khối lượng 16. Bạn cộng khối lượng 3 nguyên tử: 12 + 16 + 16 = 44 là khối lượng phân tử. Rồi chia 10g cho 44 sẽ cho kết quả xấp xỉ 0,2 mol khí cacbon đi-ô-xít.
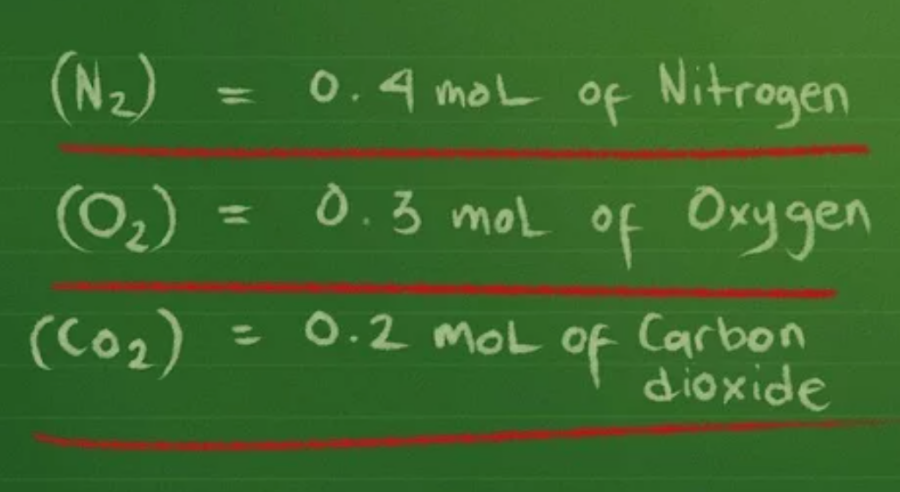
Bước 4: Thay các giá trị của mol, thể tích và nhiệt độ vào phương trình
Bạn tiến hành thay các giá trị vào phương trình: Ptổng =(0,4 * R * 310/2) nitơ + (0,3 *R * 310/2) ô-xi + (0,2 * R *310/2) cacbon đi-ô-xít.
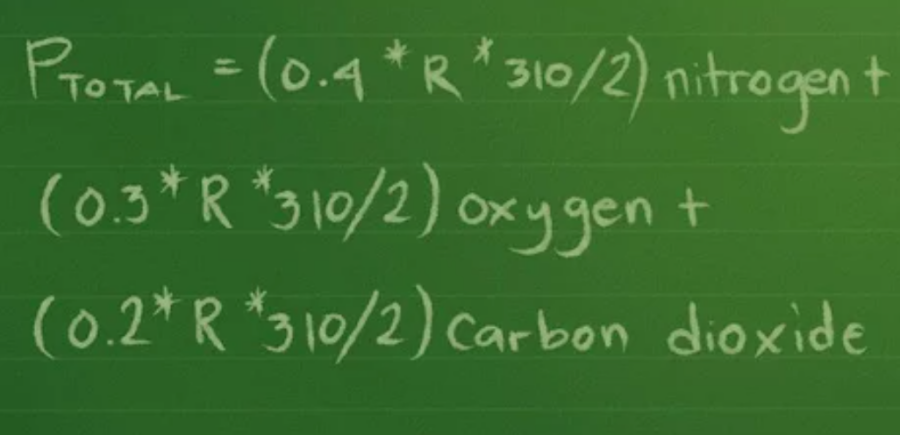
Bước 5: Thay giá trị của hằng số R
Sau khi, bạn tính ra kết quả của áp suất riêng phần và áp suất toàn phần theo atmosphere, bạn sẽ dùng giá trị R là 0,0821 L atm/K mol ⇒ Ptổng =(0,4 * 0,0821 * 310/2) nitơ + (0,3 *0,0821 * 310/2) ô-xi + (0,2 * 0,0821 * 310/2) cacbon đi-ô-xít.
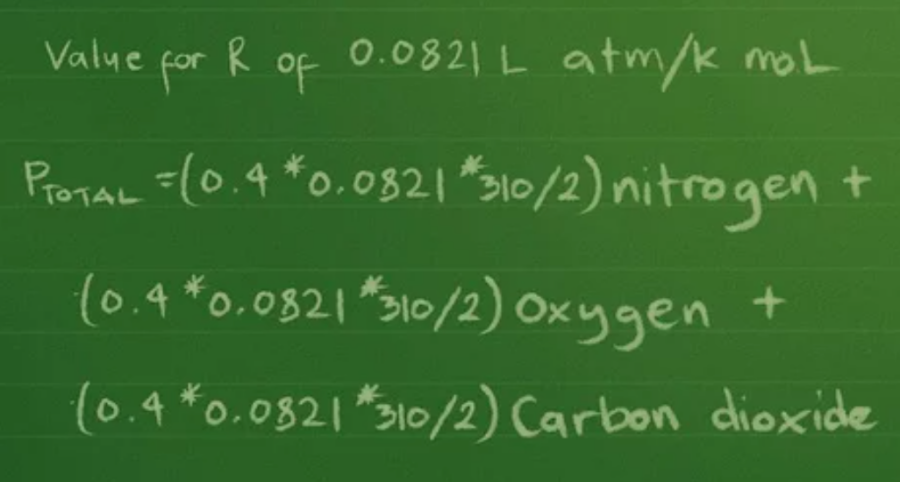
Bước 6: Tính áp suất riêng phần của từng khí
Tiếp theo, bạn tiến hành giải phương trình:
- Đối với áp suất riêng phần của ni-tơ, bạn nhân 0,4 mol cho hằng số 0,0821 và nhiệt độ 310 độ K, sau đó chia cho 2 lít: 0,4 * 0,0821 * 310/2 = 5,09 atm (xấp xỉ).
- Đối với áp suất riêng phần của ô-xi, bạn nhân 0,3 mol cho hằng số 0,0821 và nhiệt độ 310 độ K, sau đó chia cho 2 lít: 0,3 * 0,0821 * 310/2 = 3,82 atm (xấp xỉ).
- Đối với áp suất riêng phần của cacbon đi-ô-xít, bạn nhân 0,2 mol cho hằng số 0,0821 và nhiệt độ 310 độ K, sau đó chia cho 2 lít: 0,2 * 0,0821 * 310/2 = 2,54 atm (xấp xỉ).
- Sau đó, bạn cộng các áp suất để tìm áp suất toàn phần: Ptổng = 5,09 + 3,82 + 2,54 = 11,45 atm (xấp xỉ).
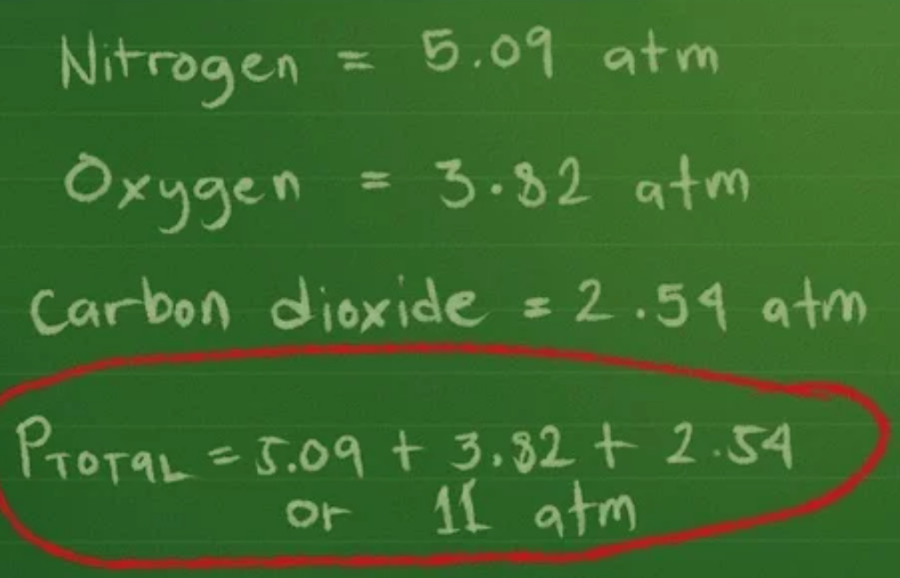
Tính áp suất toàn phần, sau đó tính áp suất riêng phần
Bước 1: Xác định phương trình áp suất riêng phần như trên
Ví dụ: Có một cái chai 2 lít chứa 3 loại khí: ni-tơ (N2), ô-xi (O2), và cacbon đi-ô-xít (CO2). Mỗi khí có 10g, và nhiệt độ của mỗi khí trong chai là 37 độ C.
Nhiệt độ Kelvin vẫn là 310 độ, bạn có xấp xỉ 0,4 mol ni-tơ, 0,3 mol ô-xi và 0,2 mol cacbon đi-ô-xít.
⇒ Kết quả áp suất theo atmosphere nên sẽ sử dụng giá trị R là 0,0821 L atm/K mol.
⇒ Phương trình áp suất riêng phần là: Ptổng =(0,4 * 0,0821 * 310/2) nitơ + (0,3 *0,0821 * 310/2) ô-xi + (0,2 * 0,0821 * 310/2) cacbon đi-ô-xít.
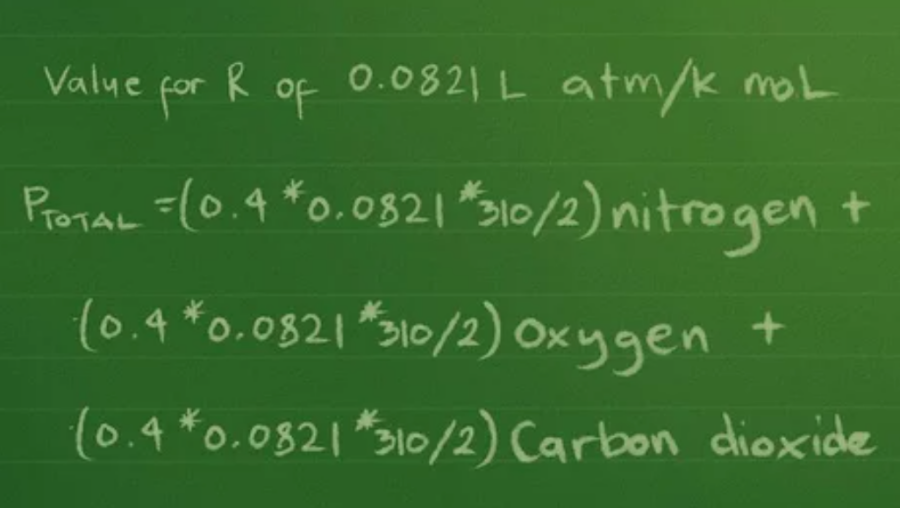
Bước 2: Cộng số mol của từng khí trong chai để tìm tổng số mol của hỗn hợp khí
Bạn viết lại phương trình: Ptổng = (0,4 + 0,3 + 0,2) * 0,0821 * 310/2.
Cộng 0,4 + 0,3 + 0,2 = 0,9 mol hỗn hợp khí. Phương trình tiếp tục được rút gọn thành Ptổng = 0,9 * 0,0821 * 310/2.

Bước 3: Tìm áp suất toàn phần của hỗn hợp khí
Sau đó, bạn lấy 0,9 * 0,0821 * 310/2 = 11,45 mol (xấp xỉ).
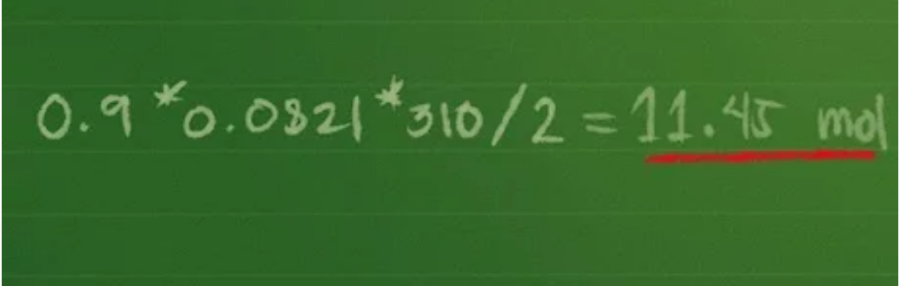
Bước 4: Tìm tỷ lệ mỗi khí tạo nên hỗn hợp
Đến đây, bạn chia số mol mỗi khí cho tổng số mol của hỗn hợp khí.
- Từ 0,4 mol ni-tơ ⇒ 0,4/0,9 = 0,44 (44%) trong hỗn hợp khí (xấp xỉ).
- Từ 0,3 mol ô-xi ⇒ 0,3/0,9 = 0,33 (33%) trong hỗn hợp khí (xấp xỉ).
- Từ 0,2 mol cacbon đi-ô-xít ⇒ 0,2/0,9 = 0,22 (22%) trong hỗn hợp khí (xấp xỉ).
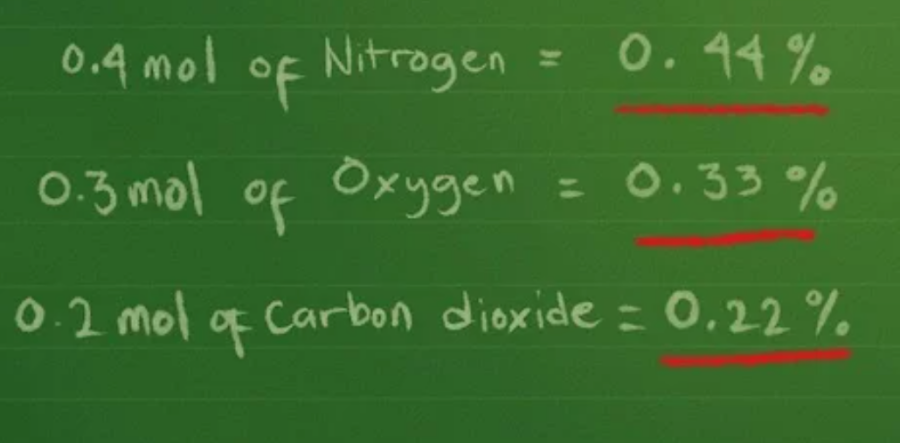
Bước 5: Nhân tỷ lệ khối lượng mỗi khí cho áp suất toàn phần để tìm áp suất riêng phần
- Lấy 0,44 * 11,45 = 5,04 atm (xấp xỉ).
- Lấy 0,33 * 11,45 = 3,78 atm (xấp xỉ).
- Lấy 0,22 * 11,45 = 2,52 atm (xấp xỉ).

IV. Một số bài tập tính áp suất
1. Bài tập tính áp suất có lời giải
Câu 1: Một ống thủy tinh đặt thẳng đứng 1 đầu kín, 1 đầu hở ở phía trên. Nửa dưới của ống chứa 1 chất khí còn nửa trên chứa đầy thuỷ ngân. Tại sao chỉ cần tăng nhiệt độ của khí trong ống đến 1 giá trị nào đó làm 1 giọt thủy ngân tràn ra thì tất cả thủy ngân trong ống sẽ tràn ra hết?
Giải:
– Ban đầu thủy ngân nằm trong ống thì áp suất phía dưới cột thủy ngân bằng với áp suất không khí trong ống
– Khi có một giọt thủy ngân tràn ra thì trọng lượng thủy ngân giảm, làm cho áp suất phía dưới cột thủy ngân giảm, nên áp suất này nhỏ hơn áp suất khí trong ống. Điều đó làm cho không khí sẽ đẩy toàn bộ thủy ngân trong ống ra hết.
Câu 2: Khi đo huyết áp của tim, vòng bít bơm hơi của máy đo huyết áp khi lồng vào tay nên đặt ngang với vị trí tim. Tại sao?
Giải: Mục đích: Để dễ dàng đo được nhịp tim và hoạt động của tim truyền máu đến phổi
Câu 3: Một xe tải 6 bánh có khối lượng 8 tấn, diện tích tiếp xúc của mỗi bánh xe với mặt đất là 7,5 cm2. Tính áp suất của xe lên mặt đường khi xe đứng yên
Giải:
Trọng lượng của vật là: P = m10 = 80.000 (N)
Diện tích của 6 bánh xe là: S = S1 x 6 = 7,5 x (10 mũ -4) x 6
Áp suất của xe tải tác dụng lên mặt đường là:
p = F/ S = 80.000 : (7,5 x (10 mũ -4) x 6) (Pa)
Câu 4: Một xe contener có trọng lượng 26000N. Tính áp suất của xe lên mặt đường, biết diện tích tiếp xúc với mặt đất là 130 dm2. Hãy so sánh áp suất đó với áp suất của một người nặng 45kg có diện tích tiếp xúc 2 bàn chân với mặt đất là 200 cm2
Giải:
Áp suất của xe tăng lên mặt đường:
p1 = F1/ S1 = 26.000/1,2 = 21666,67 (Pa)
Áp lực của người lên mặt đất là:
P2 = F2 = 10 x m2 = 10.45 = 450 (N)
Áp suất của người lên mặt đất là:
p2 = F2/ S2 = 450/ 0.02 = 22.500 (Pa)
⇒ p1 < p2
Vậy áp suất của người lớn hơn của xe contener
Câu 5:
Một xe tải có trọng lượng 340000N
a. Tính áp suất của xe tăng lên mặt đường nằm ngang, biết rằng diện tích tiếp xúc của xe với mặt đất là 1,5 m2
b. Hãy so sánh áp suất trên với áp suất của một ô tô nặng 20000N có diện tích tiếp xúc của các bánh xe là 250 cm2
Giải:
a. Áp suất của xe tải lên mặt đường là:
p1 = F1/S1 = 34.000/1,5 = 226666.6 (N/m2)
b. Áp suất của xe ô tô lên mặt đường là:
p2 = F2/S2 = 20.000/0.025 = 800.000 (N/m2)
Vậy áp suất của ô tô lên mặt đường lớn hơn áp suất của xe tải lên mặt đường
2. Bài tập tính áp suất không có lời giải
Câu 1: Một vật có khối lượng 7,5 kg buộc vào một sợi dây. Cần phải giữ dây một lực bằng bao nhiêu để vật cân bằng ?
Câu 2: Treo một vật vào một lực kế thấy lực kế chỉ 45 N.
a , Hãy phân tích các lực tác dụng vào vật . Nêu rõ điểm đặt, phương, chiều và độ lớn của các lực đó.
b , Khối 1ượng của vật là bao nhiêu ?
Câu 3: Một vật có khối lượng 5 kg đặt trên mặt bàn nằm ngang. Diện tích mặt tiếp xúc của vật với mặt bàn là 84 cm. Tính áp suất tác dụng lên mặt bàn.
Câu 4: Một vật hình khối lập phương , đặt trên mặt bàn nằm ngang , tác dụng lên mặt bàn một áp suất 36000N/m. Biết khối lượng của vật là 14,4 kg . Tính độ dài một cạnh của khối lập ph- ơng ấy.
Câu 5: Một viên gạch có các kích thước 12 cm, 14 cm, 20 cm và khối lượng 800g . Đặt viên gạch sao cho mặt của viên gạch tiếp xúc lên mặt bàn. Tính áp suất tác dụng lên mặt bàn các trường hợp có thể xảy ra.
Câu 6: Một xe bánh xích có trọng lượng 48000N , diện tích tiếp xúc của các bản xích của xe lên mặt đất là 1,25 m .
a, Tính áp suất của xe tác dụng lên mặt đất .
b, Hãy so sánh áp suất của xe lên mặt đất với áp suất của một người nặng 65kg có diện tích tiếp xúc của hai bàn chân lên mặt đất là 180 cm.
Câu 7: Một người tác dụng lên mặt sàn một áp suất 1,65.10 * N/m ?. Diện tích bàn chân tiếp xúc với mặt sàn là 0,03 mỉ. Hỏi trọng lượng và khối lượng của người đó là bao nhiêu?
Câu 8: Đặt một bao gạo 65 kg lên một cái ghế 4 chân có khối lượng 4,5 kg , diện tích
Trên đây là Công thức tính áp suất mà đội ngũ INVERT chúng tôi đã tổng hợp được. Mong rằng thông qua bài viết này các bạn hoàn toàn có thể biết công thức tính áp suất dễ dàng. Nếu có gì thắc mắc bạn cũng có thể bình luận bên dưới, chúng tôi sẽ giải đáp cho bạn. Chúc các bạn thành công.
Tags:
viết công thức tính áp suất chất lỏngcông thức tính áp suất chất khícông thức tính áp suất tuyệt đốicông thức tính áp suất chất rắn

