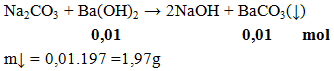Na2CO3 + Ba(OH)2 → NaOH + BaCO3 là một phương trình rất khó khi giải toán hóa học. Vì vậy trong bài viết này chúng ta sẽ cùng nhau tìm hiểu phương trình này cũng như các bài tập liên quan.
1. Phương trình phản ứng Na2CO3 + Ba(OH)2 → NaOH + BaCO3:
Na2khí CO3 + Ba(OH)2 → 2NaOH + BaCO3( )
2. Điều kiện xảy ra phản ứng Na2CO3 + Ba(OH)2 → NaOH + BaCO3:
Điều kiện phản ứng: Điều kiện thường.
3. Phản ứng giữa Na2CO3 + Ba(OH)2 → NaOH + BaCO3:
– Thả Na . giải pháp2khí CO3 vào ống nghiệm chứa Ba(OH)2
– Có kết tủa trắng.
4. Phương trình rút gọn của Na2CO3 + Ba(OH)2 → NaOH + BaCO3:
Phương trình rút gọn của phản ứng Na2CO3 + Ba(OH)2 → NaOH + BaCO3 là:
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3
5. Bài tập liên quan:
Cách cân bằng phương trình Na2CO3 + Ba(OH)2 → NaOH + BaCO3:
Để cân bằng phương trình hóa học Na2CO3 + Ba(OH)2 → NaOH + BaCO3, ta cần đảm bảo số nguyên tử của các nguyên tố ở hai vế của phương trình bằng nhau.
Vế trái của phương trình:
- Natri (Na): 2 nguyên tử (2Na2CO3).
- Cacbon (C): 1 nguyên tử (1 Na2CO3).
- Oxy (O): 9 nguyên tử (3 Na2CO3).
- Bari (Ba): 1 nguyên tử (1 Ba(OH)2).
- Hiđro (H): 2 nguyên tử (2 Ba(OH)2).
Vế phải của phương trình:
- Natri (Na): 1 nguyên tử (1 NaOH).
- Cacbon (C): 1 nguyên tử (1 BaCO3).
- Oxy (O): 5 nguyên tử (1 NaOH + 1 BaCO3).
- Bari (Ba): 1 nguyên tử (1 BaCO3).
- Hydro (H): 2 nguyên tử (1 NaOH).
Để cân bằng số lượng nguyên tử ta có thể điều chỉnh hệ số đứng trước chất phản ứng và sản phẩm. Vì các nguyên tử natri (Na) và hydroxyl (OH) đã cân bằng nên chúng ta chỉ cần cân bằng các nguyên tử cacbon (C) và oxy (O).
Vế trái của phương trình:
- Natri (Na): 2 Nguyên tử (2 Na2CO3).
- Cacbon (C): 1 Nguyên tử (1 Na2CO3).
- Oxy (O): 9 Nguyên tử (3 Na2CO3).
Vế phải của phương trình:
- Natri (Na): 2 Nguyên tử (2 NaOH).
- Cacbon (C): 1 Nguyên tử (1 BaCO3).
- Oxy (O): 9 Nguyên tử (1 NaOH + 1 BaCO3).
Để cân bằng số lượng nguyên tử carbon (C), chúng ta đặt hệ số 3 trước BaCO3 (ở vế phải của phương trình).
Na2CO3 + Ba(OH)2 → 2 NaOH + 3 BaCO3
Sau khi cân bằng, phương trình hóa học là: Na2CO3 + Ba(OH)2 → 2 NaOH + 3 BaCO3.
Mẹo cân bằng phương trình hóa học Na2CO3 + Ba(OH)2 → NaOH + BaCO3 chuẩn nhất:
Để cân bằng phương trình hóa học Na2CO3 + Ba(OH)2 → NaOH + BaCO3, bạn có thể làm theo các bước sau:
– Xác định các nguyên tố trong phương trình: Na, CO3, Ba, OH.
– Xác định số lượng nguyên tử của mỗi nguyên tố ở cả hai vế của phương trình. Hiện tại phương trình chưa cân bằng nên chưa xác định được các hệ số đứng trước phân tử/ion.
– Bắt đầu với nguyên tố có số nguyên tử khác nhau ở cả hai vế của phương trình. Trong trường hợp này, chúng ta có Ba và Na.
– Đặt hệ số trước chất để cân bằng số nguyên tử của nguyên tố đó. Với Ba, bạn có thể đặt hệ số 1 trước Ba(OH)2 và hệ số 1 trước BaCO3 để cân bằng số nguyên tử của Ba. Bây giờ phương trình trở thành: Na2CO3 + Ba(OH)2 → NaOH + BaCO3.
Tiếp tục cân bằng các yếu tố còn lại. Ở đây, chúng ta có Na và CO3.
+ Để cân bằng số nguyên tử Na ta đặt hệ số 2 trước NaOH và hệ số 1 trước Na2CO3.
+ Để cân bằng số nguyên tử CO3 ta đặt hệ số 1 trước Ba(OH)2 và hệ số 1 trước Na2CO3. Kết quả là: Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3.
Vậy phương trình đã cân bằng: Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3.
Cách giải phương trình Na2CO3 + Ba(OH)2 → NaOH + BaCO3:
Để giải phương trình hóa học Na2CO3 + Ba(OH)2 → NaOH + BaCO3 ta cần cân bằng số nguyên tử của mỗi nguyên tố ở 2 vế phương trình.
Vế trái của phương trình: Na2CO3: 2 nguyên tử natri (Na), 1 nguyên tử cacbon (C) và 3 nguyên tử oxi (O) Ba(OH)2: 1 nguyên tử bari (Ba), 2 nguyên tử hiđro ( H) và 2 nguyên tử oxi (O)
Vế phải của phương trình: NaOH: 1 nguyên tử natri (Na), 1 nguyên tử oxy (O) và 1 nguyên tử hydro (H) BaCO3: 1 nguyên tử bari (Ba), 1 nguyên tử carbon (C) và 3 nguyên tử oxy (O)
Để cân bằng phương trình, chúng ta cần đảm bảo rằng số lượng nguyên tử của mỗi nguyên tố ở cả hai bên là như nhau.
Cân bằng số nguyên tử natri (Na): Để cân bằng số natri, chúng ta cần 2 nguyên tử Na ở vế phải của phương trình. Do đó, chúng ta nhân vế phải của phương trình với 2: NaOH × 2 = 2NaOH.
Cân bằng số nguyên tử oxi (O): Để cân bằng số oxi ta cần 3 nguyên tử O ở vế trái của phương trình. Do đó, chúng ta nhân vế trái của phương trình với 3: Na2CO3 × 3 = 3Na2CO3.
Sau khi cân bằng số nguyên tử, phương trình trở thành: 3Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3
Vì vậy, phương trình được cân bằng.
BÀI TẬP VẬN DỤNG CAO:
Bài 1: Cho 4,41 gam hỗn hợp 3 muối: K2khí CO3; Na2khí CO3 và BaCO3 tác dụng vừa đủ với dung dịch HCl. Làm bay hơi dung dịch sau phản ứng thu được 4,74 gam muối khan.
thể tích khí CO22 sinh ra là:
MỘT. 0,224 lít DI DỜI. 0,448 lít CŨ. 0,672 lít DỄ. 0,448 lít
hướng dẫn giải
khí CO32- + 2 CĂN NHÀ+ → h2O + CO2↑
x 2x
mmcacbonat = mKL + mcacbonat = mKL + 60*x = 4,41 (1)
mmCl clorua = mKL + mclorua = mKL + 35,5*2x = 4,74 (2)
(2)-(1) = 11x = 0,33
x= 0,03 mol
ð VẼ TRANHCO2 = 0,672 lít
Bài 2: Dung dịch X chứa hỗn hợp Na2khí CO3 1,5M và KHCO3 1M. Thêm từ từ từng giọt cho đến khi dẫn 200 ml dung dịch HCl 1M vào 100 ml dung dịch X sinh ra V lít khí (ở ptc). Giá trị của V là
MỘT. 3.36. b. 2,24 C. 4,48. D. 1,12
hướng dẫn giải
khí CO32- + BẠN BÈ+ → HCO3– (Đầu tiên)
0,15 0,15 0,15
HCO3– + BẠN BÈ+ → khí CO2 + BẠN BÈ2Ô (2)
0,05 0,05 0,05
=> RÚTCO2 = 0,05*22,4 = 1,12 lít
Bài tập 3: Dung dịch X chứa hỗn hợp Na2khí CO3 1,5M và KHCO3 1M. Thêm từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X sinh ra V lít khí (ở ptc). Giá trị của V là
| MỘT. | 4,48. |
| b. | 1.12. |
| C. | 2,24 |
| Đ. | 3.36. |
Câu trả lời:
tôi có nCO32- = 0,15 mol và nHCO3– = 0,1 mol.
Thứ nhất: HỌ– + CO32- → HCO3–.
Sau đo họ+ + HCO3– → khí CO2↑ + BẠN BÈ2Ô.
NCO2↑ = nh+ – NCO32- = 0,2–0,15 = 0,05 mol
ĐẦMCO2↑ = 0,05 × 22,4 = 1,12 lít ⇒ Chọn XÓA
Bài 4: Dung dịch Na2khí CO3 Có thể dùng dung dịch nào sau đây?
| MỘT. | KHÔNG CÓ3. |
| b. | CaCl2. |
| C. | Na2VÌ THẾ4. |
| Đ. | KOH. |
Câu trả lời:
Trả lời DI DỜI
Bài 5: Hòa tan hoàn toàn 20,6 gam hỗn hợp gồm Na2khí CO3 và CaCO3 Với dung dịch HCl dư thu được V lít CO. thu được khí2 (dktc) và dung dịch chứa 22,8 gam hỗn hợp muối. Giá trị của V là
A. 1,79.
B. 4,48.
C. 5,60.
D. 2,24.
Câu trả lời:
Đặt nNa2CO3 = x và nCaCO3 = y (mol)
tôi hh = mNa2CO3 + mCaCO3 = 106x + 100y = 20,6 (1)
BTNT “Na”: nNaCl = 2nNa2CO3 = 2x (mol)
BTNT “Cà”: nCaCl2 = nCaCO3 = y (mol)
tôi muối = mNaCl + mCaCl2 = 58,5.2x + 111y = 22,8 (2)
Giải (1) (2) được x, y
BTNT “C” => nCO2 = nNa2CO3 + nCaCO3 => RÚT
Bài 6: Hiện tượng gì xảy ra khi Na . giải pháp được đưa ra2khí CO3 vào Al. giải pháp2(VÌ THẾ)4)3 ?
| MỘT. | Không có hiện tượng gì. |
| b. | Xuất hiện kết tủa keo trắng sau đó tan khi cho Na2khí CO3 dư. |
| C. | Xuất hiện kết tủa keo trắng, dung dịch sủi bọt khí. |
| Đ. | Xuất hiện kết tủa trắng. |
Câu trả lời:
Lưu ý: Al. muối2(CO3)3 Không tồn tại dễ bị thủy phân trong nước:
3Na2khí CO3 + Al2(VÌ THẾ)4)3 + 6 NHÀ2Ô → 2Al(OH)3↓ keo trắng + Na2VÌ THẾ4 + 3CO2 ↑
ĐÁP ÁN C
Bài 7: Sục khí Cl2 đi qua Na giải pháp2khí CO3 CO . khí được tìm thấy2 lối ra. Viết các phương trình hóa học các phản ứng đã xảy ra.
Câu trả lời:
Sục khí clo vào nước xảy ra: Cl2+H2O⇌HCl+HClO
Sau đó, 2HCl+Na2CO3−−−−−−−→2NaCl+CO2↑+H2O
Bài 8: Hấp thụ hoàn toàn 4,48 lít CO2 (dktc) vào 200ml dung dịch chứa Na2khí CO3 0,5M và NaOH 0,75M thu được dung dịch X. Cho dung dịch BaCl2 thêm vào dung dịch X được kết tủa có khối lượng . đã thu được
| MỘT. | 19,7 gam. |
| b. | 39,4 gam |
| C. | 29,55 gam |
| Đ. | 9,85 gam. |
Câu trả lời:
Bài 9: Đốt cháy hoàn toàn 5,8 gam chất X thu được 2,65 gam Na2khí CO3; 2,25g H2O2O và 12,1 gam CO2. Công thức phân tử của X là
| MỘT. | CŨ6h5Ô2Na |
| b. | CŨ6h5ONa. |
| C. | CŨ7h7Ô2Na. |
| Đ. | CŨ7h7ONa. |
Câu trả lời:
X có dạng
CŨxhyÔzNat + Ô2 → Na2khí CO3 + CO2 + BẠN BÈ2Ô
NNa = 2 × nNa2CO3 = 2 × 2,65 : 106 = 0,05 mol; Nh = 2 × nH2O = 2 × 2,25 : 18 = 0,25 mol;
NCŨ = nNa2CO3 + nCO2 = 2,65 : 106 + 12,1 : 44 = 0,3 mol
tôiÔ = mX – mCŨ – mh – mNa = 5,8 – 0,3 × 12 – 0,25 × 1 – 0,05 × 23 = 0,8 gam
→ NÔ = 0,8 : 16 = 0,05 mol
• Ta có x : y : z : t = 0,3 : 0,25 : 0,05 : 0,05 = 6 : 5 : 1 : 1 → X là C6h5ONa → Câu trả lời đúng là KHÔNG
Bài tập 10: Cho dãy các chất sau: Al, Na2khí CO3; Al(OH)3; (BÉ NHỎ4)2khí CO3. Số chất trong dãy trên vừa phản ứng được với dung dịch HCl, vừa phản ứng được với dung dịch NaOH là
Câu trả lời:
Trả lời MỘT
Bài 11: Cho các chất: Na2CO3, BaCl2, BaCO3, Cu(OH)2, Fe, ZnO. Chất nào trên phản ứng được với dd H2SO4 loãng tạo thành:
Một. tạo kết tủa trắng
b. Là chất khí nhẹ hơn không khí và cháy được trong không khí
c. khí nặng hơn không khí và không duy trì sự cháy
đ. kết tủa trắng cũng là một chất khí nặng hơn không khí và không duy trì sự cháy
đ. dd màu xanh
f. dd không màu viết các phương trình phản ứng trên
Câu trả lời:
Một,
BaCl2+ H2SO4 -> BaSO4+ 2HCl
BaCO3+ H2SO4 -> BaSO4+ CO2+ H2O
b,
Fe+ H2SO4 -> FeSO4+ H2
c,
Na2CO3+ H2SO4 -> Na2SO4+ CO2+ H2O
BaCO3+ H2SO4 -> BaSO4+ CO2+ H2O
d,
BaCO3+ H2SO4 -> BaSO4+ CO2+ H2O
e,
Cu(OH)2+ H2SO4 -> CuSO4+ 2H2O
f,
Na2CO3+ H2SO4 -> Na2SO4+ CO2+ H2O
Fe+ H2SO4 -> FeSO4+ H2
ZnO+ H2SO4 -> ZnSO4+ H2O
Ví dụ 1:
thêm từ từ vài giọt Na2khí CO3 vào ống nghiệm chứa 1ml Ba(OH)2 thu được kết tủa có màu
A. trắng. B. đen. C. vàng. D. màu nâu đỏ.
hướng dẫn giải
Na2khí CO3 + Ba(OH)2 → 2NaOH + BaCO3( )
BaCO3( ) trắng
Đáp án A
Ví dụ 2:
Chất nào sau đây không phản ứng được với Na.?2khí CO3?
A. Ba(OH)2. B. BaCl2. C. Ba(KHÔNG3)2. D, BaCO3.
hướng dẫn giải
BaCO3 không phản ứng với Na2khí CO3.
Đáp án D .
Ví dụ 3:
Khối lượng kết tủa thu được khi thêm Na2khí CO3 phản ứng vừa đủ với 100ml Ba(OH)2 0,1 triệu là
A. 2,33 gam. B. 2,17 gam. C.1.97 gam. D. 2,00 gam
hướng dẫn giải
Đáp án C