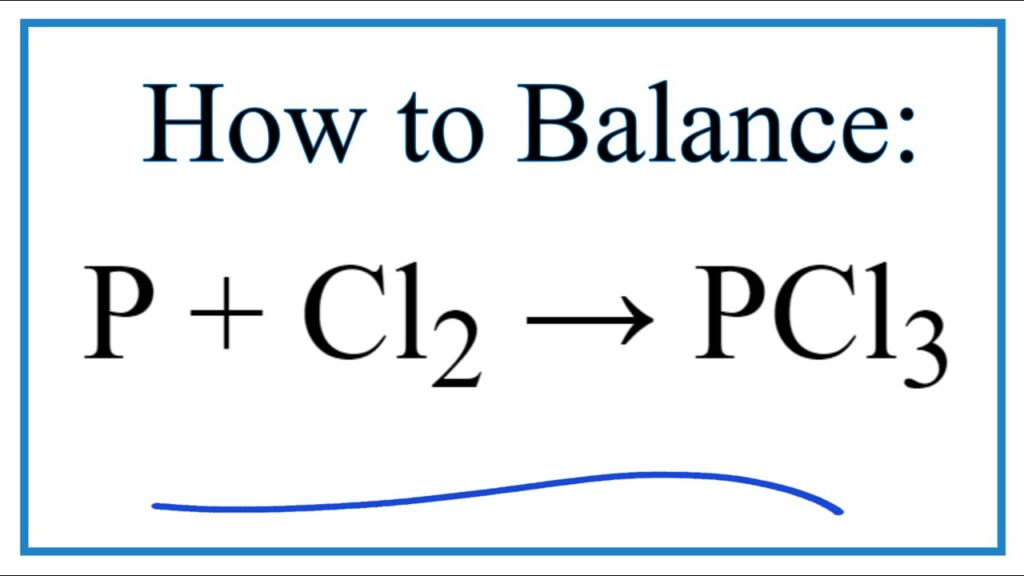
1. Phương trình phản ứng P ra PCl3:
P + Cl2 → PCl3
2. Phân tích Phương trình phản ứng hóa học P + Cl2 → PCl3:
Thứ nhất, điều kiện phản ứng photpho tác dụng Clo ra PCl3 là có nhiệt độ và thiếu Clo.
Thứ hai, hiện tượng đốt cháy photpho trong khí Cl2 thiếu sẽ cho kết quả là có xuất hiện màu vàng lục của khí Cl2 (Clo) nhạt dần khí phản ứng xảy ra.
Thứ ba, các thực hiện phản ứng: Đốt P trong bình chứa khí Cl2. P tác dụng với Cl2 dư, nhiệt độ thì sẽ tạo ra PCl5. Bởi: Về bản chất của P (Photpho) trong phản ứng trên là chất khử. P là phi kim tương đối hoạt động thể hiện tính khử khi tác dụng với các phi kim hoạt động như O2, halogen, S và các hợp chất oxi hóa mạnh khác. Bản chất của Cl2 (Clo) trong phản ứng trên, Cl2 là chất oxi hóa.
3. Bài tập vận dụng liên quan:
Câu 1: Khi đốt cháy photpho trong khí Cl2 dư thì sản phẩm thu được là
A. PCl3.
B. PCl5.
C. PCl6.
D. PCl.
Câu 2: Photpho tác dụng với chất nào sau đây?
A. Cl2.
B. NaCl.
C. H2O.
D. NaOH.
Câu 3: Cho photpho tác dụng với các chất sau: NaOH, Ba, O2, Cl2, KClO3, HNO3 và H2SO4 đặc, nóng. Photpho tác dụng được với bao nhiêu chất trong số các chất trên?
A. 6
B. 5
C. 4
D. 7
Câu 4: Dãy chất đều phản ứng được với photpho là
A. NaCl, Ba, O2, HNO3 đặc, nóng
B. NaCl, Ca, O2, H2SO4 đặc, nóng
C. NaOH, Ba, Cl2, HNO3 đặc, nóng
D. Ba, O2, Cl2, HNO3 đặc, nóng
Câu 5: Khi đốt cháy photpho trong khí Cl2 thiếu thì sản phẩm thu được là
A. PCl3
B. PCl5
C. PCl
D. PCl4
Câu 6: Photpho tác dụng với chất nào sau đây?
A. Cl2
B. NaCl
C. H2O
D. NaOH
Câu 7: Hiện tượng gì xảy ra khi đốt P trong bình chứa khí Cl2 thiếu?
A. Không có hiện tượng gì.
B. Màu vàng lục của khí clo nhạt dần.
C. Màu vàng lục của khí clo chuyển dần sang màu đỏ.
D. Chuyển từ không màu sang màu vàng
4. Hướng dẫn lời giải:
Câu 1: Đáp án: PCl5.
Câu 2: Đáp án: A. Cl2.
Câu 3: Đáp án: A. 6
Câu 4: Đáp án: D. Ba, O2, Cl2, HNO3 đặc, nóng
Dãy chất đều phản ứng được với photpho là D. Ba, O2, Cl2, HNO3 đặc, nóng.
Câu 5: Đáp án: A. PCl3
2P + 3Cl2 thiếu t⁰> 2PCl3
Câu 6: Đáp án: A. Cl2
2P + 3Cl2 t⁰> 2PCl3
Câu 7: Đáp án: B. Màu vàng lục của khí Clo nhạt dần.
2P + 3Cl2 t⁰> 2PCl3
5. Tìm hiểu thêm về Photpho (P):
5.1. Photpho được hiểu như thế nào:
Phốt pho là một nguyên tố hóa học cần thiết cho tất cả các tế bào sống. Hợp chất phốt phát hữu cơ axit deoxyribonucleic (DNA) cung cấp mã di truyền cho sự sống. Và adenosine triphosphate (ATP) rất cần thiết cho quá trình chuyển hóa năng lượng của tế bào. Trong nông nghiệp, phốt pho là một trong ba chất dinh dưỡng chính của cây trồng, cùng với nitơ và kali.
Phốt pho nguyên tố thường được gọi là phốt pho trắng – P4 chỉ cần thiết để sản xuất một lượng hóa chất hạn chế. Và hầu hết phốt pho được tiêu thụ trên toàn thế giới ở dạng phốt phát.
5.2. Đặc điểm của Photpho:
Phốt pho (P) là một nguyên tố hóa học phi kim thuộc họ nitơ. Nó thuộc nhóm 15 [Va] của bảng tuần hoàn. Ở nhiệt độ phòng, phốt pho là chất rắn sáp không màu. Nó trở nên trong suốt, mềm mại và phát sáng trong bóng tối.
Một số đặc trưng nguyên tố của photpho:
Số nguyên tử: 15
Trọng lượng nguyên tử: 30.9738
Điểm nóng chảy đối với photpho trắng: 44.1°C (111.4 °F)
Điểm sôi đối với photpho trắng: 280 °C (536 °F)
5.3. Tính chất vật lí của Photpho:
Photpho thường gặp 2 hình thù phổ biến là P đỏ và P trắng.
Thứ nhất, Photpho trắng:
‐ Nó là chất rắn trong suốt trắng hoặc vàng nhạt trong suốt có cấu trúc mạng phân tử: các nút mạng chứa các phân tử tứ diện P4 liên kết với nhau bằng tương tác yếu. Do đó photpho trắng mềm dễ nóng chảy (t0nc = 44,10 C)
– Photpho trắng không tan trong nước mà tan trong các dung môi hữu cơ như benzen, cacbon disunfua, ete,…; Rất độc, gây bỏng nặng khi tiếp xúc với da.
‐ Photpho trắng bốc cháy trong không khí ở nhiệt độ t0 > 400C, nên bảo quản và bảo quản bằng cách ngâm trong nước.
‐ Ở nhiệt độ phòng, photpho trắng phát huỳnh quang màu lục sáng trong bóng tối. Khi nung nóng đến 2500 C không có không khí, photpho trắng chuyển dần thành photpho đỏ, một dạng ổn định hơn.
Thứ hai, Photpho đỏ:
‐ Là chất bột màu đỏ có cấu trúc polime nên khó nóng chảy và khó bay hơi hơn photpho trắng
– Photpho đỏ khó tan trong các dung môi thông thường, dễ hút ẩm và nóng chảy.
– Photpho đỏ bền trong không khí ở nhiệt độ thường và không phát quang trong bóng tối. Nó chỉ bốc cháy ở nhiệt độ t0 > 2500 C. (Cấu trúc polyme của phốt pho đỏ) Sự thay đổi giữa phốt pho trắng và đỏ.
‐ Trong điều kiện không có không khí, photpho đỏ khi đun nóng biến thành hơi, khi làm lạnh hơi của nó ngưng tụ thành photpho trắng và đỏ.
5.4. Tính chất hóa học của Photpho:
‐ Các mức oxi hóa hoàn toàn có thể có của P: – 3, 0, + 3, + 5.
‐ P hoạt động hóa học mạnh hơn N2 vì vì link P – P kém bền hơn so với link N ≡ N.
‐ P trắng hoạt động giải trí hơn P đỏ (vì P trắng có kiểu mạng phân tử còn P đỏ có cấu trúc của Polyme).
Thứ nhất, Tính oxi hóa của Photpho:
‐ P có phản ứng với nhiều sắt kẽm kim loại →-tạo ra muối Photphua
2P + 3M g → Mg3P2.
‐ Các muối photphua bị thủy phân mạnh giải phóng photphin ( PH3 ).
Ca3P2 + 6H2O → 2PH3 + 3Ca(OH) 2
‐ Photphin là một khí không màu rất độc, có mùi tỏi, bốc cháy trong không khí ở nhiệt độ gần 1500C.
2PH3 + 4O2 → P2O5 + 3H2O
Thứ hai, Tính khử của Photpho:
‐ Phản ứng với phi kim : O2, halogen, ..4P + 3O2 → 2P2 O34P + 5O2 → 2P2O5 ( nếu O2 dư ).
‐ P trắng phản ứng được ở ngay nhiệt độ thường và có hiện tượng kì lạ phát quang hóa học; P đỏ chỉ phản ứng khi nhiệt độ > 2500C.
2P + 3Cl2 → 2PC l32P + 5C l2 → 2PC l5
‐ Phản ứng với những chất oxi hóa khác
6P ( đỏ ) + 3KClO3 → 3P2O5 + 5KCl ( phản ứng xảy ra khi quẹt diêm )
6P ( trắng ) + 5K2 Cr2O7 → 5K2O + 5Cr2O3 + 3P2O
5P + 5HNO3 → H3PO4 + 5NO2 + H2O2P + 5H2SO4 đặc → 2H3PO4 + 3H2O + 5SO2
5.5. Điều chế và ứng dụng của photpho:
Thứ nhất, trạng thái tự nhiên của photpho:
Trong tự nhiên chỉ sống sót ở dạng hợp chất. Hai khoáng vật chính là apatit 3Ca3 (PO4) 2.CaF2 và photphorit Ca3(PO4)2.
Thứ hai, điều chế photpho:
Trong công nghiệp, photpho được sản xuất bằng cách đun nóng hỗn hợp quặng photphorit, cát và than cốc ở trong lò điện :Ca3 ( PO4 ) 2 + 3SiO2 + 5C → 3CaSiO3 + 2P + 5CO ( lò điện ở 15000C ).
Thứ ba, ứng dụng của photpho:
Hầu hết phốt pho được chuyển hóa thành axit photphoric, phần còn lại được sử dụng chủ yếu để sản xuất diêm. Ngoài ra, phốt pho trắng có các ứng dụng quân sự chiến lược chủ yếu do tính dễ cháy của nó, tạo ra các đám khói và hơi độc. Photpho trắng cháy ngay khi tiếp xúc với oxi ở nhiệt độ thường và tạo thành ngọn lửa rất độc đối với con người. Photpho đỏ không cháy ở nhiệt độ thường và thường được dùng làm hóa chất trong công nghiệp và nông nghiệp.
Acid phosphoric đậm đặc, có thể chứa tới 70% – 75% P2O5 là rất quan trọng đối với ngành nông nghiệp do nó được dùng để sản xuất phân bón.
Nhu cầu toàn cầu về phân bón dẫn đến sự gia tăng đáng kể trong sản xuất phốt phát (PO43-) trong nửa sau của thế kỷ 20. sử dụng khác bao gồm: Phốt phát được sử dụng trong sản xuất kính đặc biệt được sử dụng trong đèn hơi natri; Tro xương, canxi phốt phát, được sử dụng trong sản xuất đồ sứ. Natri tripolyphotphat, được làm từ axit photphoric, được sử dụng trong bột giặt ở một số quốc gia, nhưng bị cấm ở một số quốc gia khác; Axit photphoric, được làm từ phốt pho nguyên tố, được sử dụng trong các ứng dụng như nước giải khát. Axit này cũng là điểm khởi đầu để sản xuất phốt phát thực phẩm. Những hóa chất này bao gồm canxi photphat được sử dụng trong bột nở và natri tripolyphotphat và các photphat natri khác. Những hóa chất này được sử dụng, trong số những ứng dụng khác, để cải thiện các đặc tính của thịt hoặc pho mát đã qua chế biến. Nó cũng được sử dụng trong kem đánh răng. Natri photphat được sử dụng trong các sản phẩm tẩy rửa để làm mềm nước và chống ăn mòn đường ống/nồi hơi.
Ngoài ra, Photpho được sử dụng rộng rãi để sản xuất các hợp chất hữu cơ chứa photpho thông qua các chất trung gian như photpho pentaclorua và photpho sunfua. Những chất này có nhiều ứng dụng, bao gồm chất làm dẻo, chất chống cháy, thuốc trừ sâu, chất chiết xuất và chất làm sạch nước. Nguyên tố này cũng là một thành phần quan trọng trong sản xuất thép, đồng phốt-pho và nhiều sản phẩm tương tự khác.
Phốt pho trắng được sử dụng trong các ứng dụng quân sự như bom cháy, trong việc tạo màn khói như hộp khói và bom khói, và trong pháo sáng.
Photpho đỏ được dùng để sản xuất diêm, pháo hoa và đặc biệt là methamphetamine (C10H15N). ‐ Một lượng nhỏ phốt pho được sử dụng làm chất thêm trong chất bán dẫn loại n. Phốt pho P32 và phốt pho P33 được sử dụng làm chất đánh dấu phóng xạ trong phòng thí nghiệm sinh học.